Robert Maniura
Sprawozdanie z ćwiczenia nr 30: Liczby przenoszenia jonów.
1. Wstęp teoretyczny:
W przewodzeniu prądu przez roztwór biorą udział zarówno jony dodatnie, jak i ujemne. Podstawowe znaczenie ma więc wyznaczenie ułamka ładunku elektrycznego przenoszonego przez każdy jon w danym elektrolicie. W tym celu wprowadzono tzw. liczby przenoszenia t + i t -, określające ułamki ogólnego ładunku elektrycznego przenoszone przez kation i anion. Z definicji tej wynika zależność:![]()
W przewodnikach metalicznych cały ładunek elektryczny przenoszony jest przez elektrony, a zatem dla takich przewodników t - = 1, t + = 0. W przypadku roztworów elektrolitów najczęstszą metodą, którą określamy ułamki ładunku elektrycznego przenoszone przez aniony i kationy, jest metoda Hittorfa.
Rozważmy, co dzieje się w przestrzeni katodowej i anodowej, w czasie elektrolizy kwasu azotowego (V), przeprowadzonej w aparacie Hittorfa.
przestrzeń katodowa - w wyniku wędrówki jonów zmienia się tu stężenie jonów H+ i NO3-; oprócz tego na katodzie następuje wydzielenie 1 gramorównoważnika H+ w reakcji
Pt(-) 2H+ + 2e- → H2 zmianę liczby gramorównoważników H+ i NO3- możemy policzyć wiedząc, że jest on równy sumie reakcji elektrodowej i efektu migracji: ![]()
- otrzymujemy wartość -t -;
przestrzeń anodowa - stężenie jonów H+ i NO3- zmienia się również w skutek ich wędrówki oraz reakcji utlenienia tlenu zachodzącego na anodzie
2H2O → 4H+ + O2 + 4e- przy czym zmiana liczby gramorównoważników H+ i NO3- liczymy jak wyżej ![]()
i otrzymujemy wartość +t -;
Powyższe obliczenia tyczyły zmiany liczby gramorównoważników, nie zaś zmian stężenia i są one podstawą wprowadzonej przez Hittorfa metody wyznaczania liczb przenoszenia. Istnieją również inne metody wyznaczania liczb przenoszenia, jednak powyższa metoda w sposób wystarczający ilustruje sens tych wielkości i zasadę ich określania.
2. Opracowanie wyników:
Elektrolizę prowadzono pod natężeniem prądu I = 50 mA, w czasie 3600 s. Do miareczkowania użyto roztworu NaOH o stężeniu 0,05 mol/dm3 oraz pobierano po 5 cm3 próbek. Stężenie jonów wodorowych w próbkach można obliczyć na podstawie zależności:
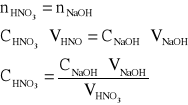
Lp. |
VNaOH zużyte dla roztworu wyjściowego [cm3] |
VNaOH zużyte dla przestrzeni anodowej [cm3] |
VNaOH zużyte dla przestrzeni katodowej [cm3] |
1. |
7,7 |
9,45 |
6,2 |
2. |
7,7 |
9,45 |
6,2 |
3. |
7,7 |
9,5 |
6,15 |
wartość średnia |
7,7 |
9,47 |
6,18 |
stężenie [mol/dm3] |
CW = 0,077 [mol/dm3] |
CA = 0,0947 [mol/dm3] |
CK = 0,0618 [mol/dm3] |
Obliczam liczby przenoszenia jonów z następujących zależności:
![]()
gdzie: ![]()
- liczba przenoszenia H+; ![]()
- liczba przenoszenia NO3-; n - zmiana liczby moli w przestreniach katodowej i anodowej; F - stała Faradaya; Q = I * t - ładunek przepuszczony przez roztwór HNO3 w czasie t = 3600 [s] i natężeniu 50 [mA] = 0,05 [A].
Zmianę liczby moli n można obliczyć wykorzystując zmianę stężenia w przestrzeniach katodowej i anodowej:
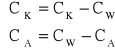
gdzie: CK - zmiana stężenia przestrzeni katodowej; CA - zmiana stężenia przestrzeni anodowej; CW - stężenie początkowe; CK - stężenie przestrzeni katodowej po przeprowadzonej elektrolizie; CA - stężenie przestrzeni anodowej po przeprowadzonej elektrolizie.
Zmiana stężeń w przestrzeniach katodowej i anodowej pomnożone przez całkowite objętości tych przestrzeni (VK i VA) dadzą nam zmianę liczby moli:
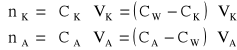
gdzie: VK = 41 cm3 = 0,041 dm3; VA = 35 cm3 = 0,035 dm3.
Z tych założeń można obliczyć ostatecznie liczby przenoszenia:
![]()
![]()
![]()
Zatem:
![]()
Porównanie z wartościami literaturowymi:
Liczba przenoszenia |
Wartość eksperymentalna |
Wartość literaturowa |
Błąd procentowy |
|
0,3330 |
0,1650 |
101,82 % |
|
0,6670 |
0,8350 |
20,12 % |
4. Wnioski:
W przypadku roztworów elektrolitów dokładne określenie liczby przenoszenia jest trudne, choć istnieją metody pozwalające na wyznaczanie tych wartości z dużą dokładnością. Doświadczenie wykonane przeze mnie nie jest doświadczeniem skomplikowanym, lecz uzyskane wyniki odbiegają od danych literaturowych. Błędy procentowe wynoszą odpowiednio 101,82 % i 20,12 %.
Cel ćwiczenia został osiągnięty, pomimo odchyleń od danych literaturowych (wskutek błędów metodycznych popełnionych przeze mnie).
2
Wyszukiwarka
Podobne podstrony:
B-2.1 Liczby przenoszenia jonow, Księgozbiór, Studia, Pozostałe
Ćwiczenie 2 - liczby przenoszenia i ruchliwosc jonow, Biotechnologia PWR, Semestr 3, Chemia fizyczna
Prawo inżynierskie i ochrona własności intelektualnych. Wykład 3, Studia, Politechnika Łódzka - Pend
Testy biodegradacji, Studia, Politechnika
Chf9, Studia, Politechnika
Wyznaczanie stałej reakcji szybkości zmydlania estru, Studia, Politechnika
02 Liczby przenoszenia i Ruchliwość
CH.F.L9, Studia, Politechnika
ZAKAAD CHEMI FIZYCZNEJ, Studia, Politechnika
C15, Studia, Politechnika
podstawowe informacje o ochronie prawnej wzorów przemysłowych, Studia - Politechnika Śląska, Zarządz
Sprawko spawalnictwo 1, studia, studia Politechnika Poznańska - BMiZ - Mechatronika, 2 semestr, obro
dziadek25, Studia, Politechnika
4 2 vademecum echosondy (w tym przykładzie wodnej), studia, studia Politechnika Poznańska - BMiZ - M
LABORKA7, Studia, Politechnika
Wyznaczanie stopnia asocjacji kwasu octowego w rozpuszczalni, Studia, Politechnika
deacon1, Studia, Politechnika
Destylacja wojtek, Studia Politechnika Poznańska, Semestr I, Chemia, Chemia laboratoria, Destylacja
103, Studia Politechnika Poznańska, Semestr II, I pracownia fizyczna, LABORKI WSZYSTKIE, FIZYKA 2, F
więcej podobnych podstron