Jacek Olender I rok KiR
ĆWICZENIE II - SPRAWOZDANIE
Część praktyczna
Treść: Za pomocą reakcji zobojętniania, przy użyciu oznaczonego roztworu HCl o stężeniu 0,1000n oznaczyć stężenie roztworu ok. 0,1n NaOH wykonanego w ćwiczeniu I.
Obliczenia:
Wzór zachodzącej reakcji zobojętniania:
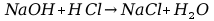
Stąd wiadomo, że współczynniki stechiometryczne kwasu i zasady w tej reakcji wynoszą 1:1. Oznacza to, że na każdy mol zobojętnianej zasady przypada jeden mol kwasu. Daje to wzór: nzasady=nkwasu.
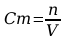 ,
czyli:
,
czyli:
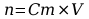
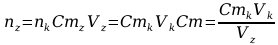 .
Za Vk przyjęto arytmetyczną średnią z objętości
trzech pomiarów przeprowadzonych w następującym doświadczeniu:
.
Za Vk przyjęto arytmetyczną średnią z objętości
trzech pomiarów przeprowadzonych w następującym doświadczeniu:
Mając do dyspozycji odczynniki:
-roztwór ok. 0,1n z ćwiczenia I
-mianowany roztwór HCl o stężeniu 0,1n
-oranż metylowy
oraz przyrządy:
-biureta 25 cm3
-pipeta jednomiarowa o objętości 10 cm3
-kolba stożkowa Erlenmayera 3 sztuki
-kroplomierz
Wykonano następujące czynności:
Do trzech kolb Erlenmayera nalano po 10 cm3 ok. 0,1n roztworu NaOH z ćwiczenia I
Do każdej kolby wkropiono po trzy krople oranżu metylowego
Biuretę napełniono mianowanym roztworem HCl o Cm=0,1mol/dm3
Każdą próbkę roztworu NaOH miareczkowano do pierwszej zmiany barwy indykatora
Otrzymano kolejno trzy objętości kwasu zużyte do zmiareczkowania roztworu NaOH:
- 10,3 cm3
- 10,5 cm3
- 10,6 cm3
Z powyższych pomiarów wyciągnięto średnią arytmetyczną równą 10,47 cm3.
Po wykonaniu doświadczenia można podstawić wartości do wzoru:

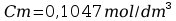
Obserwacje:
W wyniku miareczkowania wykazano, iż dokładne stężenie roztworu NaOH wykonanego w ćwiczeniu pierwszym wynosi 0,1047 mol/dm3.
Wnioski:
Stężenie roztworu z ćwiczenia pierwszego różni się od założonego. Może to być spowodowane:
- przybliżeniami przyjętymi w obliczeniach w ćwiczeniu pierwszym
- niedokładnościami w pomiarach przy wykonywaniu roztworu
- błędem systematycznym miareczkowania alkacymetrycznego
- błędem przy wykonywaniu miareczkowania.
Wyszukiwarka