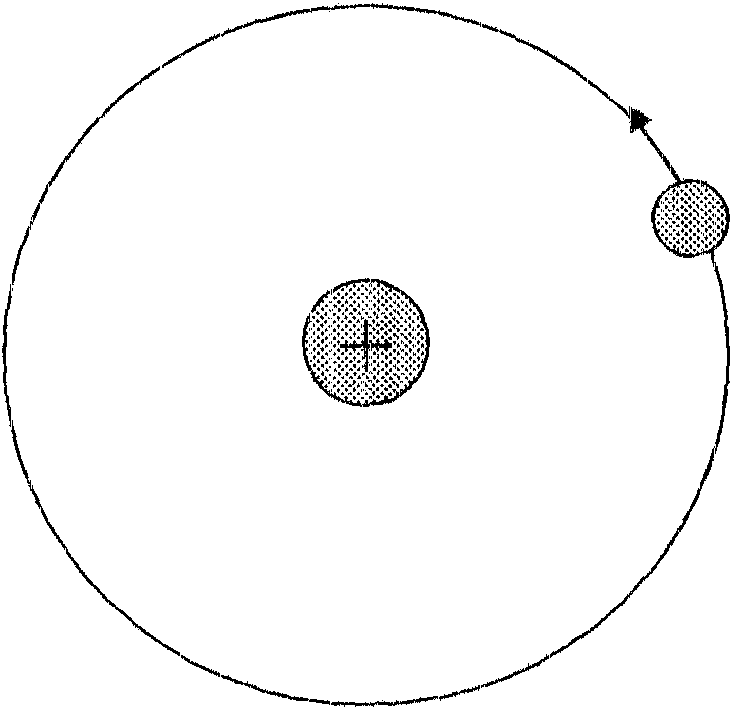
Model Bohra
Jądrowy model atomu Rutherforda vv połączeniu z klasyczflą mecłlaniką. i elektrodynamikc~ nie jest \v stanie wyjaśnić ani stabilności atoll1U, ani charakteru widma atomowego.
W 1913 r. d,uLński fizyk~ l'~iels Bohr znalazł ~1)j ście
z povvstałego tlI impasu, co prawda, kosztenl wprovvadzenia założeń. sprzecznych z klasycznymi wyol)rażeniamL Przyjęte przez Bohra założenia za"varte są w dW'óch SfOflTIułowanych przezeń postulatach.
![]()
Pierwszy postulat Bobra
Elektron nie może krążyć po dowolnej orbicie, lecz ty/kopo tych, dla których moment pędu elektronujest wielokrotnością h/27r.
h - stała nazwana stałąPlancka wynosząca 6~162*10-34J*s
Każdej orbicie od.powiada inn_y stan. el1ergety'czny atomu .. ZnajdlljąC się na orbicie dozwolonej ele1~troll tlie pronlieniuje erlergii. Orbity (lozwolone zostały nazwal1e stacjonarn~yrni.
])rugi postulat Bo:hra
Atom absorbu;fe lub emitu}oepromieniowanie w postaci kwantu
o energii hu przechodząc z je dne .. go stanu ener(getycznego En do tśrugiego Ek (cz)Tli przej ściu lelektronu z jednej orbity clozw<?lonej tła inl1ą) o
RÓżl1ica energii tych stanów atonló"V rÓ'Wl1a się energii wyp1fomieniowanego kwantu:
![]()
We wzorze tym En oznacza energie atolnu w stanie pocZą~koVV)Tm, En - '\i'V stanie końcoWYIll, v - jest częstotliwością emito'wanego ltlb zaabsorbovvarlego prorIlieniowaniao Energia zostaje 'NYproITlieniowana, gd)T En> lik' pochłonięta zaś, jeżeli En < Eko
'Trzeci P()stlllat Bohra
Pra'-~/a mechanilsj opisują rÓwnowagę dynarrliczllą elektronó1vI vV stanac.h stacjollarnych_~, ale l1ie stOSllją się do przec:hodlzenia elel(tronu I)Olniędzy (iwoma stanarni stacjonalTlymi.
Zgodnie z pierwszy"m postulatem Bollra możliwe są tylko takie orbity, dla których moment pę1du elektronu m9vr spełnia 'warunel(
c
111 l/'r == 1111
e
(n== 1,2,3, .... )
Liczbę n nazywam.y głólt1ną liczbą k:M/antową. Rozpatrzlny elektro]n poruszaj~y się 1{vV p,olu j~jra atomo'\vego o ładulnku Ze. Przy Z :::::: 1 taki lIkład odpo'wiada ato:mowi wodoru~ przy illn)Tcll Z .. jonowi ,vodoJropodobrlelTIU, tj. atonlo,~vi o liczbie atolllO\\T1ej Z', z którego USUllięto wszystkie elektrony oprócz jedllego.
Obecnie teoria Bohra ma głó\vnie znaczenie historyczne.
Po pierwszych sllkcesach tej teorii coraz barclzi~j 'Nidoczne stawały się jej niedociągllięcia. Szczególnie przygnębiające b:yły nier)(y~vodzenia vvszystkich prÓb sk.on.struovvania teorii atol1).u.11elu jedJlego z Ilajprostszych atomÓw, następnego atomu bezpośredIlio 1)0 atomje wodoru.
Po odla~ycill falowych \vłasno:ści materii, stało się zllpełnie jasrle, i~e oparta na rnec]lanice 1~lasycznej teoria Bohra nlogła być jedy'nie przej ŚciOvv)i'nl etal)em na drodze do st\vorzenia konsek'wentrlej teorii zjawisk atorrlowych.
a) Dualizm korpuskularno - falowy, efekt fotoelektryczny, efekt Comptona, dyfrakcja, interferencja.
Dualizm korpuskularno-falowy- cecha wielu obiektów fizycznych (np: światła czy elektronów) polegająca na tym, że w pewnych sytuacjach, zachowują się one jakby były cząstkami (korpuskułami), a w innych sytuacjach jakby były falami.
Wg mechaniki kwantowej właściwie całą materię charakteryzuje ten dualizm. Każdej cząstce, a nawet każdemu obiektowi makroskopowemu można przypisać charakterystyczną dla niego funkcję falO\vą. Z drugiej strony każde oddziaływanie falowe można opisać
w kategoriach cząstek

s

Efekt fotoelektryczny
I I ~
+
!!!!I!!!!!I -
I
l
[
Rozproszony foton
Emisja elektronów z katody zachodzi tylko WÓWCZ<l.s, gdy długość fali światła padającego nie przekracza pewnej wartości progowej "czerwonej linii efektu fotoelektrycznego". Ta graniczna wartość 10 = dnO jest charakterystyczna dla metalu katody.
W
'1-a
z tp.o-o ';'p. enp.rgl'<>
f'r\tr\nu m"s; pr\C'l<>rlac'
i\.. """'5, L..<V ~~'"'~ "..L"-'L"-' ~.1. Y.1 '-'~.1.u. ••••.•.
pevvną minimalną wartość, poniżej której nie jest możliwe wybicie elektronu z katody. Nadmiar energii
h
\
J'e""
~"m;",
•.. ;., •.. n
•.• " energl'ę
kl·net'u'~ •.. "
J l .. - J i:)L L(l.1..l .1 ••••• .11.1.U11] .HU. Y\.IL.l.!'ł
elektronu.
Efekt Comptona
h
D
r\s'"r;adczp.nl·e
nolp.,,<>Jr\ na rr\'7DroQ'7p.n;n
prOll1;enlnur<>nla ~nnto-p.na na parar.l111;e Cr\mnton
stu1l'erdzl'ł
'-J' ':".L '-' .•. j-' "'-5"".ł.'-".ł..ol- .L '-J'L.J ..•. .L •....• L.J...., .•.•.•• .ł. .ł..ł..ł.'-.' ł'y ~.L.L ..L'-'-".ł.J.~b""".L.L .L 1..ł.. '"--' .•. .Ly •.•. .l. •...•• ." ,
że długość fali promieniowania rozproszonego jest większa niż pierwotnie.
W przeciwieństwie do zjawisk interferencji czy dyfrakcji promieniowania elektromagnetycznego efektu fotoelektrycznego oraz efektu Comptona nie da się wyjaśnić na drodze teorii falowej.
Dyfrakcja - odchylenie się fai od prostoliniowego kierunku rozchodzenia się, np. po przejściu przez szczelinę.
Interferencja - nakładanie się fal prowadzące do zwiększenia lub zmniejszenia amplitudy fali wypadkowej.
1
4. Hipoteza de Broglie' a.t
Dualizm korpuskularno-falowy jest cechą nie tylko światła (fotonów), lecz i wszystkich cząstek materialnych o masie spoczynkowej różnej od zera, np. elektronów
E=hv,
hv p=-=mv c
A=~
mv
Przykład: dla kuli o masie 19, wystrzelonej z prędkością 300 m/s, l jest rzędu 1O~31 cm (h =ó,ó24 . 1034J·s),
5. Liczby kwantowe n, I, m i s, zakaz Pauliego.
n - główna liczba kwantowa, określa przede wszystkim energię elektronu w atomie. Główna liczba kwantowa może przybierać tylko wartości równe liczbom naturalnym: n = 1,2, 3,
k
.
';' r7' ~,
7no' '. L'
t·o II
d n
i \ .. ' . K
r M'
NT
O P"
Q
n o rre::ua p.~ynale~u~sc eleK.r~n_ o yoz.omow. , ..... , '1, ~, , ,
I - poboczna liczba kwantowa, bvantuje moment pędu związany z ruchem elektronu w polu jądra. Dla danego n wartości l vrynoszą:
O, 1,2, .. " (n-l). Liczba l oheśla przynależność do orbitali: s, p, d,J: g ...
m - magnetyczna liczba kwantowa, decyduje o możliwych wartościach składowej momentu pędu w
w
'
zn' ll'o-y-n- kl'eruTIK'--
'~) Dhl{ł~neg() l
rooz'
'l' nTe w-artos'·c:i m
wy-no~zą'
O +1
+? + l
11 1 __ U \.L .. __ u,:t! _. _ 1 YY' •• _'_ H' :S, _, _ , _ ~, .. " _ .
s - spinmva liczba kwantowa, kręt elektronu, może przyjmować wartości ±l!2. Ma ona duże znaczenie przy tworzeniu wiązań chemicznych.
Zakaz Pauliego
lVlożliwe są tylko takie stany elektronowe w atomie, w których żaden elektron nie ma identycznych wszystli'jch czterech liczb kwantowych.
2
6. Kolejność zapełnienia poziomów energetycznych.
E
6s
6p
![]()
Sd
![]()


',viązania chemiczne: jonowe, kowalencyjne, kowalencyjne spolaryzowane,
koordynacyjne, wodorowe, oddzialJr;yania yan der Waałsa.
Wiązania jonowe występują w układach złożonych z atomów skrajnie różniących się elektroujemnością·
W czasie powstawania wiązania jonowego atom pierwiastka elektrododatniego oddaje, a atom pierwiastka elektroujemnego przyłącza elektrony. Tworzą się dwa jony o różnoimiennych ładunkach, przyciągające się dzięki działaniu sił elektrostatycznych.
Wiązania atomowe (kowałency,jne) powstają również, gdy łączą się ze sobą atomy pierwiastków elektroujemnych o takich samych wartościach elektroujemności.
Podobnie jak w wiązaniu jonowym, wiążące się atomy dążą do osiągnięcia strukiu:ry oktetowej najbliższego gazu szlachetnego.
Wiązania tego typu występują w cząsteczkach ID, e12, 02, N2 itp. Przykładem jest wodór dla którego pojedynczy atom ma jeden elektron.
Gdy dwa atomy wodoru tworzą cząsteczkę, ich elektrony rozmieszczają się symetrycznie wokół obydvv'u jąder, tworząc parę elektronową.
fII!Ii
H + fll!liH
-->
![]()
![]()
W wiązaniu atommvym wiążąca para elektronmva znajduje się \v jednakowej odległości od jąder
. h"
atomovV tvvorzącyc ~ Vvlązanle~
Wiązanie atomowe spolaryzowane jest \viązaniem pośrednim między jonowym a ato111o-wym; powstaje wówczas, gdy łączą się ze sobą atomy pierwiastków różniących się elektroujemnością, lecz nie tak znacznie jak w przypadku tworzenia wiązania jonowego. Cechą charakterystyczną tego wiazania ;fest przesuniecie Dary e1ektronowei wiażacei atomy \'1 kierunku atomu nienviastka bardzie1
••..•. 1..J. J :J •..•.. :J.., j. oJ
elektroujemnego.

Cząsteczki z wiązaniami kowalencyjnymi spolaryzowanymi z powodu nierównorniernego,
nie symetrycznego w stosunku do środka cząsteczki, rozmieszczenie ładunków wykazują biegunowość. W cząsteczkach tych wyróżnić można biegun dodatni i ujemny. Cząsteczki o budowie polarnej nazywamy dipoiami, tzn. cząsteczkami dwubiegunowymi. Cząsteczki dvitubiegunowe mają tzw. moment dipolowy u
Wiązanie koordynacyjne tym różni się od wiązania atomowego lub atomowego spolaryzowanego, że para elektronowa tworzących wiązanie oddawana jest przez jeden z dwóch łączących się atomów. Najprostszym przykładem pmvstawania wiązania koordynacyjnego jest tworzenie się jonu amonowego
4
Połączenia, w których \,')'stępują wiązania koordynacyjne noszą nazwę związków koordynacyjnych, związków kompleksowych, albo kompleksów.
W związku kompleksowym wyróżnia się atom centralny i cząsteczki koordynowane zwane ligandami.
\Viązania wodorow~ Jest to słabe oddziaływanie elektrostatyczne pomiędzy elektroujemnym ~!?mem(akceptorem), a atomemwodorut który jest kowalencyjnie połączony z innym atomem elektrou.jemnym (donorem); VI wiązaniu tym wodór pełni rolę mostka łączącego dwa elektroujemne atomy;
![]()

.. - ..
:~~*. ~:tf~ -~ J'~ f~:: \~~~ t~:~j (t:f~tHł.~-~~:
. [tlE nt~'l
~r~~-·-- -. ~- - . ..,- .. ~ .. - .. -- - ~
![]()
Q,Il;!4nnl: w@,ą:;t~lnf,~ ·kDW1:l:NHrt:1f:f:n::~,
Siły van der Waalsa
sąbardzosłabymi oddziaływaniami zachodzącytlłi.p<m1iędZ'j wszy~t1Pami atomó~(zaróvmo polarnymi jak i niepolarnymi), W chmurze elektronowej otaczającej jądro pojawiać się mogą chwilowe fluktuacje rozmieszczenia ładunków ujemnych - wynik normalnego ruchu elektronów. Takie nieregularności prowadzą do powstawania i zanikania dipoli, które wpływają na rozmieszczenie elektronów w sąsiednich atomach.
Gdy atomy znajdujące się w bezpośrednim sąsiedztwie mają spolaryzowane chmury elektronowe, pojav,riać się może słabe przyciąganie. Zanika ono bardzo szybko wraz ze wzrostem odległości między
a
'
natoilll'a"t gAy atorrny zn<>;dą "l'ę '7h,,+
hl;.,}"" ";eh;e '7r."t<>lą r...t"DPhn;"te
prz"z ;pdnr.;m;enne
.l. . .1. ,ol .1..L U ~ .l..1..L .l.~J u- LJujL 1,J.l..l.jJ-.ł.~'--' OJ.l U.L L...l'L'UL~J ~-""J.. ""' .•. .l:.l. .l.'t'"' •••• J'" .l.~'" .•..•.
ładunki chmur elektronowych.
Oddziaływania van der Waalsa odpowiadają na przykład za przyciąganie się cząsteczek niepolarnych cieczy oraz stanowią siły łączące składniki ścian komórkowych (poprzez przyciąganie się niepolarnych łańcuchów fosfolipidów).
8. Prawo działania mas Guldberga i 'Vaagego.
Stała równowagi - prawo działania mas Guldberga i Waagego
nA +mB = qC + rD
K = [eF ·[DY c [Ar .fBr
Ł ~
Substancje reagują tak długo, dopóki stosunek iloczynu stężeń produktów do iloczynu stężeń substratów nie osiągnie pewnej
stałej wartości, charakterystycznej dla da.."1ej reakcji i dla temperatury
5
Wyszukiwarka
Podobne podstrony:
Chemia Bionie wyk1
chemia powt
Wykład Chemia kwantowa 11
wyklad z czwartku chemia fizycz dnia19 marca
chemia(1) 3
Chemia węglowodory
Chemia organiczna czesc I poprawiona
ERGONOMIA chemia
chemia organiczna wykład 6
Chemia wyklad I i II (konfiguracja wiÄ…zania Pauling hybrydyzacja wiazania pi i sigma)
Chemia procesu widzenia
Chemia R cje chemiczne
Chemia materiałów V
Wykład 9 CHEMIA ORGANICZNA
CHEMIA NIEORGANICZNA 2
Chemia