53.Prawo
addytY"~nośd absorpcji.
Absorbancja
roztworu wieloskładnikowego równa się sumie absorbancji
poszczególnych składników:
A
=
Al +
Az +
+ An
~e'
a
=
O
.1"2.1"2
{1
t
l
. , 1-'
,-, fi,
a
t
~
""C
54.
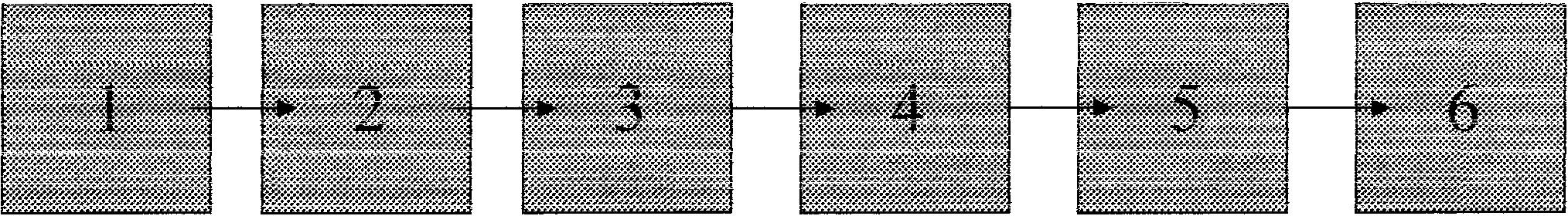
Schemat blokowyabsorpcjometrów.
1
- Źródło promieniowania
2
- Regulator natęzenia prornieniowania 3 - Regulator długości fali
4
- Kuweta z próbką
5
- Detektor
6
- Wskaźnik lub rejestrator
Kolorymetr
- przyrząd
pomiarowy służący do wykonywania analiz kolorymetrycznych na
podstawie określenia absorpcji lub poróv/n)l~"vania
absorpcji
rozt\"llorów.
I
I
TT
lH""",-j-<l
'7 ["zhuor""m
_
l\...\ .
..lVV\.Itct
L
V
-LV"
\.-1_1
-'6
~n",lrfrOK'
olo~rmetr zalólfo<ilfiUJóJlnł"e snoso'h nfimi<:łru
••...
..- II ••....••• łJi
.•....• ll..,
• ..iI...Il
J
,
IJ.
tJ'-'.,.
•. ~..ii...il
, ł'
Al
ł''-'..ii...iL.Iil..ii.
•.•...•. II
Spektrokolorymetr
I
'7rA
'Jr,
l
.[ Układ
optyczny l
••
< .et
.•. ł
I
lu~~
....
I
i~'.lViiV\..tIH.VUjatv.l
l
J
UT7mar-nl;acz
1
y,.
L...i..L
.. LL \,,1...1...1
ł
Wvś'vietlacz
.
ol'
-
.
!
Lampa
\~/olframo\"va lub rtęciov~la
Fotoogniwo
Spektrofotometria
LIV-VIS jest
powszechnie stosowana w analizie ilościowej, a także do
identyfikacji związków organicznych i do badania związków
kompleksowych
57.
Spektrofotometria w
podczerwieni
(IK)
Absorpcja
promieniowania w podczerwieni wiąże się na ogół ze zmianami
stanów oscylacyjnych w cząsteczce. Ponieważ zmianie energii
oscylacji towarzyszy zmiana energii rotacji obserwowane
31
g
d
z
l

![]()
widma
są widmami oscylacyjno-rotacyjnymi.
Widmo IR związku chemicznego składa się z zespołó"v pasm, charakterystycznych tylko dla tego Z'.viązku (odcisk palca). Fakt ten wykorzystuje się do identyfikacji grup strukturalnych, vvystępujących w związku.
58. Nefelometria i turbidymetria.
Nefelometria jest metodą analityczną, opartą na pomiarze natężenia światła rozproszonego (lub nd<hit""o-o' T.r nr?"'7 cz"'st"""?k; iTnio;liou7"" (7<lnl;""",in" """"ui",i",,' Ul irl'''''r11n1nu r/"7nVm oli ki""runiru nadania
'\J v~ •... vó J.L.J ł-'~.L.iVL..,! "t LVVL.1 .1 i\.v~ ..lu. ~-YV \"'-'UVVl.\..IL7.1i..1)', V1. .. Ll . .ioYJVj YY ..i."'- V.1\,..i.iHlo- :l.'łJL..i.J.J.l.1 ~ 1. .l.V.1. .. L.i:~. ł" 1. ..l
światła (zazwyczaj pod kątem 900 lub 450).
![]()
v - objętość cząstek
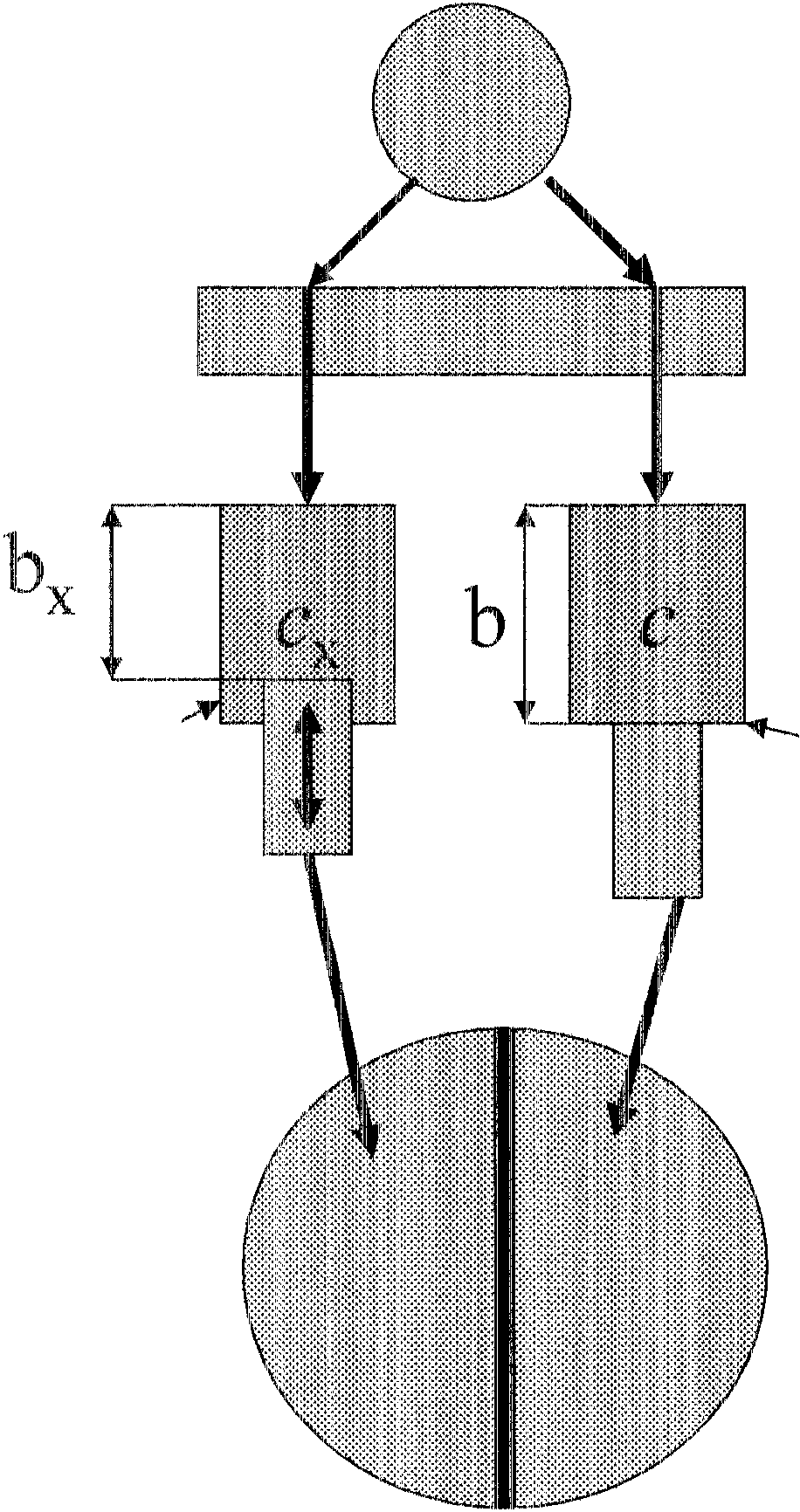
Turbidymetria bada zależności Iniędzy natężeniem światła padającego 10 a natężeniem światła przechodzącego przez roztwór Ip
Przez analogię do spektrofotometrii, w turbidymetrii wprowadza się Pojęcie absorbancji pozornej Ap, zwanej inaczej wartością zmętnienia:

b - gmbość warstwy próbki, c - stęiepje,
d - średnia wartość przekroju cząstek, 'tv- długość fali,
k, a - stałe.
59.Absorpcyjna spektrometria atomowa. (osobna kartka)
60. Ekstrakcja.
Ekstrakcja to proces wyodrębniania z ciał stałych lub mieszanin związków chemicznych, polegający na ich płukaniu rozpuszczalnikiem. W trakcie ekstrakcji zachodzi fizyczny proces absorpcji i desorpcji, powodujący przenikanie cząsteczek rozdzielanego związku chemicznego do rozpuszczalnika.
Kluczowym zagadnieniem przy wykonywaniu ekstrakcji jest odpowiedni dobór rozpuszczalników. 'Wyszukuje się takie rozpuszczalniki, które selektywnie absorbująjeden związek chemiczny i nie absorbują pozostałych.
Ekstrakcję przeprowadza się zwykle przez intensywne mieszanie rozpuszczalnika z ekstrahowaną cieczą lub rozdrobnionym ciałem stałym a następnie rozdzielenie faz poprzez sedymentację, filtrowanie lub odwirowanie, \V laboratoriach ekstrakcję przeprowadza się w rozdzielaczach.
61.Konduktometria; kondunktancja; konduktywność.
Kondllktometria, dział elektrochemii oraz metoda chemicznej analizy instrumentalnej obejmujące
b
",rlania
nrzeulodnictula ""lektruC7n""gn e1""ktrn"litAu7
(nr7""u7odnich~l'" ;nnoul""an'
nn
pAml" ",rAul
U'\o,A. j,j, pi. VV 1.'&'.1. V"V V.i. .i..JL.l.i..i.~ -"-1 .i.'W.ł. ..•••• .LV "''''lVV'' "P A....>_V'i .i..i.i. f.,V'ir......JV.i..i. •• " .•••• ÓV). -L.FV V.i..i..i. ~J.'-JV'i
przewodności roztworów elektrolitów służy konduktometr.
Jednostką przewodności właści\vej jest simens na metr, Sim. Przewodność vvłaściwa vłOdy destylowanej jest rzędu 10.5 Sim i szybko rośnie ze wzrostem stężenia rozpuszczonych w wodzie substancji jOllO\.vych.
Konduktancja (przewodność elektryczna) jest odvlrotnością rezystancji. Jest więc miarą podatności elementu na przepływ prądu elektrfcznego.
Zwyczajowo konduktancję oznacza się symbolem G (1Nielka litera G).
32
Jednostką konduktancji w układzie SI jest simens (1 S).
J\lIiarą podatności materiału na przepływ prądu elektrycznego jest konduktywność. Dla znanych wymiarów geometrycznych prze\vodnika i konduktywność materiału, z jakiego został 'Aiykonany, jego
konduktancię określa wzór: .C:
- . /'" ,~
\J = crT
gdzie: l - długość przewodnika, S - pole przekroju poprzecznego elementu, Ci - konduktywność właściwa materiahl.
Konduktancja dotyczy obwodów prądu stałego, a w obwodach prądu zmiennego tylko elementów rezystancyjnych (rezystor). Uogólnieniem i rozwinięciem pojęcia konduktancji na eiementy pojemnościowe (kondensator) i indukcyjne (cewka) jest admitancja.
K
nn.rlułK~"'nn~c'
(nr'7p"vodnn<ic'
elplrlnJ'C7p a
ulł~<S~;'Xl~
'\ to
m1arJ:l
podatnn~C.l·
mMpriJ:lłul
nJ:l przephT\v
u. _ .i.,J 'i'i' _lo.lP \ . .t'-""--'-'" i •..•.•...... ..L ••••••.••••..•.•.•. L...l.l. TT _u __ .•. l'". ••..•.. J •....•..•...•.•...•.•...•..•..•...•.•..•..•.. .L •••.•• ",_..L..L_"'" "- ..•.•••.•• LJ TV
prądu elektrycznego.
Konduktywność jest zazwyczaj oznaczana jako cr (mała grecka litera sigma), Jednostką konduktywności w układzie SI jest simens na metr (l Sim). Odwrotność konduk1:vwności to rezvstvwność.
~ ~ ~
Konduktywność materiału vvyznaczyć można znając wymiary geometrjczne i konduktancję
jednorodnego bloku danego materiału:
l:-/ ..•..• ! {'.t_l'
(T =
B.
gdzie: G - konduktancja, S - pole przekroju poprzecznego elementu, l - dh3gość elementu.
W ogólności konduktywność metali spada przy wzroście temperatury, a konduktywność
P
Ałpr'7o'l~!r'\.rłn1t.-oF
"J>T
""("ll7r13s+a
'l"'lrt'"'t:l'7
"7
+e"",,"ł"-o
.•.. o+u
•. n
V.l
.l.L.I\.IV~V\ •. U.Llfi.
VV
Vl'L...lU" Vl'.laL.. L..J
" .1.l..lPV.1U\. .l'ł:.'
62.Zależność kondu.ktywnośd od stężenia elektrolitu.
63.IVIiareczkowanie konduktometryczne.
l\iiareczkowanie konduktometryczne - chemiczna technika analityczna polegająca na dodawaniu roztworu odczynnika (titrant) z biurety w postaci kropel do roztworu zwanego roztworem analitu, i jednoczesnym pomiarze oporu (przewodnictwo) danego roztworu, po każdorazowym dodaniu titranta. Miareczkowanie konduktometrfczne, polega na miareczkowaniu kwasu zasadą lub na odwrót. Bardzo ruchliwe jony hydroniowe, są zastępowane mniej ruchliwymi kationami metali. Powoduje to spadek przewodnictwa całego układu. Po osiągnięciu punktu zobojętnienia, rośnie stężenie jonów hydroksylowych, które także są bardzo ruchliwe. Przewodnicnvo zwiększa też jednocześnie coraz większa sumaryczna ilość jonów w roztworze.
Przy miareczkowaniu słabych kwasów, nie zauważa się początkowego spadku przewodnictwa, gdyż od razu powstaje mocny elektrolit. Pomimo tego po osiągnięciu punktu równoważnikowego, stężenie jonów hydroksylowych i ciągłe zwiększanie się sumy wszystkich jonów, powoduje powstanie \vyraźnego załamania w punkcie zobojętnienia na krzywej rniareczkowania. Przy miareczkowaniu mieszaniny mocny - słaby kwas, najpierw zostaje zneutralizowany mocny kwas.
33
![]()
![]()
![]()
Kolorymetr
l'
ZrÓdło śV1viatła
/'/
I)róbl(a łJadalla /"/
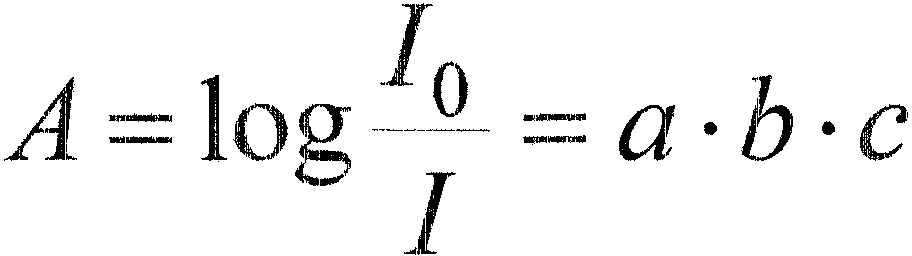
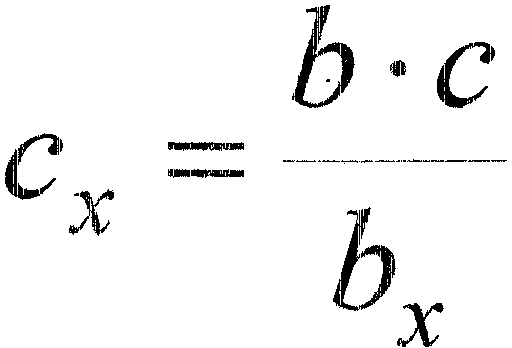
•••••••••• •••••• -- __ 1Il"""'.-_ •••
---"-- \VT zorzec
()l(lllar
1If59.Absorpcyjna spektrometria atomowa

c
[
----------J
----------,
Lampa z katodą wnękową
Atornizer Środowisko absorpcj i
![]()
R.ej estrator
1\1 T ' •
'n zmacnlacz
Detektor
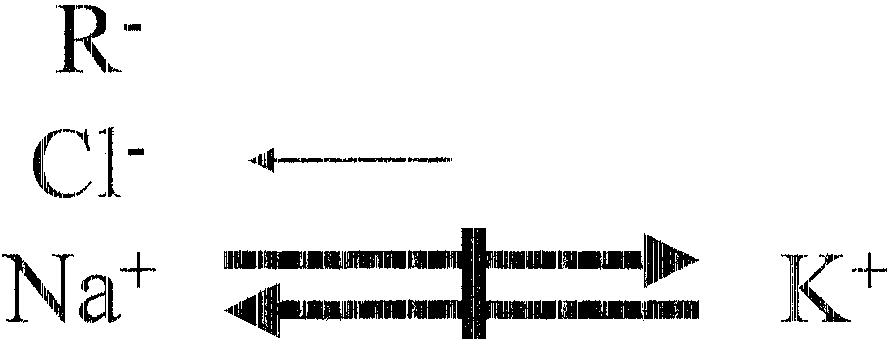
Interdyfuzj a Donnano"Nska (wykluczenie Donnaua)
|
|
R~- |
I |
C:lu |
|
|
(ł |
|
|
(~, |
|
|
~'1 |
1\fa+ |
1(+ |
||
|
"'" |
____ o (:1'"
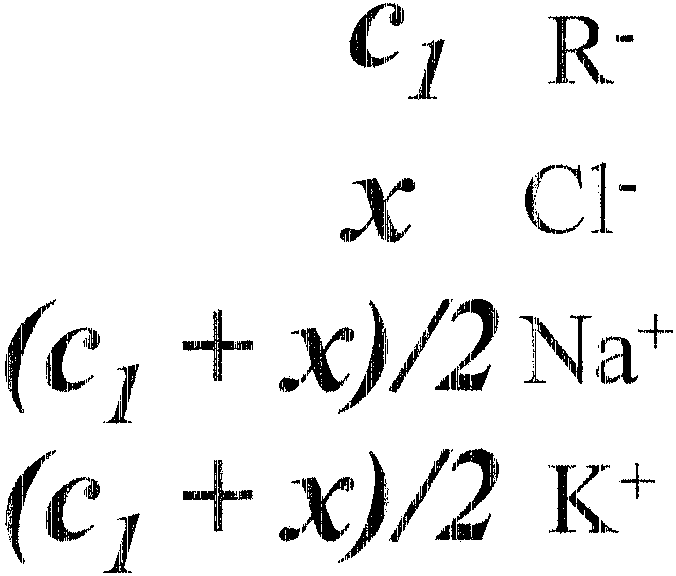
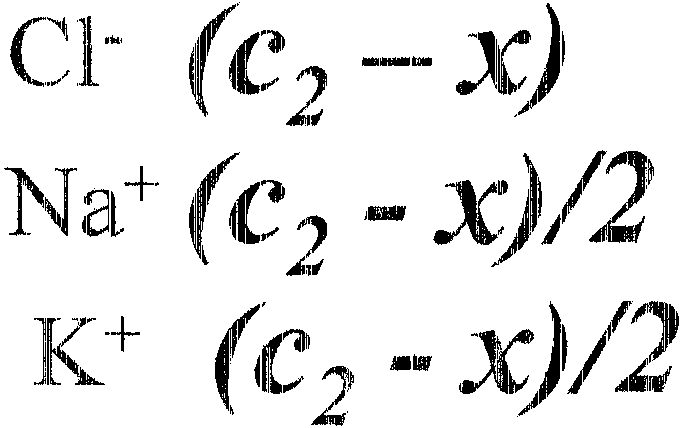

Wyszukiwarka