|
Szostak Jakub |
Rzeszów |
|
Wydział budownictwa Grupa W2 Zespół L13 |
04.04.2005r. |
Sprawozdanie z laboratorium fizyki
Ćwiczenie 23
Sprawdzanie praw elektrolizy Faradaya.
I . Wprowadzenie.
Jeśli związek jonowy np. NaCl, ulegnie rozpuszczeniu w wodzie, której cząsteczki mają budowę rozciągniętych dipoli, to w wyniku oddziaływania elektrycznego na spolaryzowane cząsteczki związku jonowego nastąpi rozpad tych ostatnich na oddzielne jony. Zjawisko to nosi nawę dysocjacji elektrolitycznej, natomiast roztwór związku ulegającego rozpadowi na jony, nazywa się elektrolitem.
W roztworach wodnych dysocjacji ulegają: kwasy, zasady i sole, przy czym tworzące się jony wodoru i metali są dodatnie, zaś jony grupy wodorotlenowej OH lub reszty kwasowej (np. Cl- , NO3-) - ujemne. W elektrolicie jony znajdując się w stanie bezwładnego ruchu cieplnego zderzają się wzajemnie oraz z cząsteczkami wody. Zderzenie się jonów o znakach przeciwnych powoduje zobojętnienie ich ładunków i utworzenie cząsteczki substancji rozpuszczonej (np. NaOH). Zjawisko to nosi nazwę rekombinacji jonów.
Stosunek liczby cząstek ulegających dysocjacji, do całkowitej liczby cząstek zawartych w roztworze nazywamy stopniem dysocjacji elektrolitu, przy czym jego wartość wzrasta ze wzrostem temperatury i maleje ze wzrostem stężenia roztworu. Zjawisko dysocjacji występuje również po stopieniu związku jonowego.
Po wprowadzeniu elektrolitu CuSO4 płyt metalowych i połączeniu ich ze źródłem napięcia rozpoczyna się, pod wpływem wytworzonego pola elektrycznego, uporządkowany ruch jonów, równoznaczny z przepływem prądu elektrycznego. Aniony po zetknięciu z anodą oddają nadmiar elektronów, zaś kationy zobojętniają się na katodzie tworząc cząsteczki odpowiednich związków. Reakcje zachodzące na elektrodach noszą nazwę pierwotnych, gdyż w rzeczywistości zobojętnione jony reagują z materiałem elektrody lub z wodą w elektrolicie, otrzymane substancje różnią się od bezpośrednich produktów rozkładu. Zjawisko to nosi nazwę elektrolizy. Ilościowo zjawisko to ujmują prawa Faradaya.
Cechą charakterystyczną zjawiska elektrolizy jest to, że wraz z ładunkiem przez elektrolit jest przenoszona stosunkowo duża masa jonów. Przy przepływie pojedynczego jonu - przez elektrolit przeniesiona zostaje masa jonu “m’ ” oraz ładunek elektryczny równy iloczynowi wartościowości “w” jonu i ładunku elementarnego “e”. Przy przepływie “n” jonów zostaje przeniesiona masa “m” m=nm’ i ładunek “q” q=nwe , przy czym stosunek
 [
1 ]
[
1 ]
jest dla danego elektrolitu wielkością stałą (e i m’ są dla określonego jonu stałe). Wielkość “k” [kg/C] zwana równoważnikiem elektrochemicznym, określa liczbowo masę substancji w kg wydzielonej z elektrolitu przy przepływie ładunku równego 1 C.
Ponieważ m=kq , q=I t , gdzie I natężenie prądu stałego płynącego przez elektrolit, t - czas trwania elektrolizy otrzymujemy równanie:
m = kit [ 2 ]
stanowiącą treść pierwszego prawa Faradaya: masa “m” substancji wydzielonej z elektrolitu na elektrodzie jest wprost proporcjonalna do natężenia I prądu oraz czasu t.
Jeżeli przez elektrolit przepłynie liczba jonów równa liczbie Awogadra Nd , to ich masa jest równa masie 1 kilomola, czyli wyrażonej w kg/mol masie cząsteczkowej m , ładunek zaś iloczynowi Ndwe, a więc
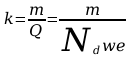 [
3]
[
3]
Ponieważ iloczyn Nde ma stałą wartość, zwaną stałą Faraday’a i równą F=Nde=6.022*1020*1.602*10-19C/kmol=96.49C/kmol , więc:
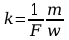 [
4]
[
4]
Stosunek
wyrażonej w kg/kmol masy cząsteczkowej m
jonu do jego wartościowości w nosi nazwę równoważnika
chemicznego . Wzór [ 4 ] stanowi treść drugiego prawa Faraday’a:
równoważnik elektrochemiczny k substancji wydzielonej z elektrolitu
jest wprost proporcjonalny do jej równoważnika chemicznego
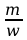 .
.
Podstawiając
prawą stronę równania [ 4 ] do [ 2] otrzymujemy wzór łączący
obydwa prawa Faraday’a.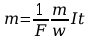
II. Wykonanie ćwiczenia.
Przyrządy: analityczna waga laboratoryjna, elektrody miedziowe z zamocowaniem, amperomierz, zasilacz, sekundomierz.
1. Połączyć obwód wg schematu:
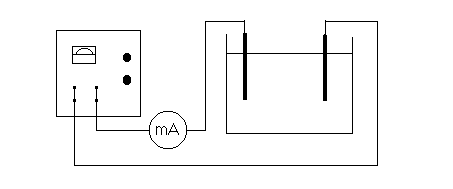
2. Sprawdzić poprawność obwodu elektrycznego zamykając obwód na krótki czas. Równocześnie regulować natężenie prądu w obwodzie, tak by gęstość nie przekraczała 0.5 A/dm2 (natężenie prądu wyznaczyć w oparciu o powierzchnie elektrody).
3. Wyjąć katodę, oczyścić starannie papierem ściernym, wypłukać wodą. Wyznaczyć masę m1 katody korzystając z analitycznej wagi laboratoryjnej.
4. Umieścić ponownie katodę w elektrolicie, włączyć prąd uruchamiając jednocześnie zegar. Utrzymać stałą wartość natężenia prądu przez czas t=30 minut.
5. Po upływie tego czasu przerwać przepływ prądu. Opłukać katodę wodą, osuszyć i wyznaczyć masę m2 katody. Masę wydzielonej miedzi obliczyć ze wzoru m=m2-m1. Przekształcając wzór m=kIt obliczyć równoważnik elektrochemiczny miedzi.
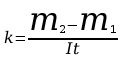
6.
Z układu okresowego pierwiastków odczytać masę atomową miedzi
mCu
, wartościowość miedzi w=2 i ze wzoru wyrażającego II prawo
Faraday’a obliczyć stałą Faraday’a:
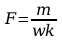
7. Wyniki wpisać do tabelki.
Błędy pomiarów: Dm1=m[ ] , Dm2=m[ ] , Dt=m[ ] , DI=m[ ]
z8. Wskazówki do opracowania błędów:
Masę miedzi wydzieloną w procesie elektrolizy wyznacza się ważąc katodę na wadze analitycznej przed zamknięciem obwodu i po przerwaniu elektrolizy. Za błąd jakim obarczona jest wydzielona masa miedzi uważać będziemy sumę błędów popełnionych przy obu ważeniach wynikającą z dokładności wagi. Aby osiągnąć dużą dokładność ważenia należy przed przystąpieniem do pomiarów sprawdzić poziome ustawienie wagi oraz wyznaczyć zerowe położenie wskazówki wagi nie obciążonej. Czas trwania elektrolizy mierzy się sekundomierzem. Ponieważ proces trwa 30 minut pomiar czasu można określić z dokładnością do kilkunastu sekund.
Błąd DI obliczyć z klasy przyrządu pomiarowego.
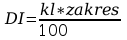
Błąd bezwzględny obliczyć drogą różniczkowania.
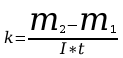
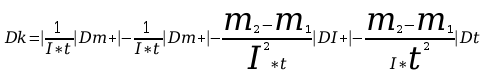
Błąd DF obliczyć metodą różniczkowania.
Błąd względny dk obliczyć wg zależności
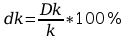
Błąd dF analogicznie jak dk.
Zapis końcowy wyniku:
k=(kśrmDk)
F=(FśrmDF) [C]
10. Tabelka.
|
I |
m1 |
t |
m2 |
m |
k |
kmDk |
F |
FmDF |
|
[mA] |
[ |
[s] |
[ |
[ |
[kg/c] |
[kg/c] |
[c/kmol] |
[c/kmol] |
|
200 |
77,216 |
1800 |
77,321 |
0,11 |
|
|
|
|

m=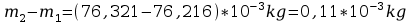
k=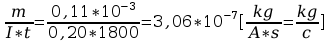
k=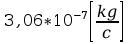
F=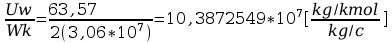
F=
Błędy pomiarów:
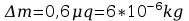

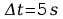
Błąd obliczeń równoważnika elektrochemicznego:

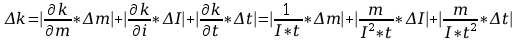
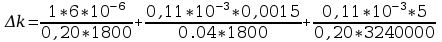
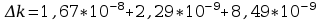
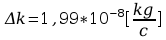
Błąd obliczeń stałej Faradaya:
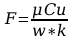
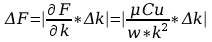
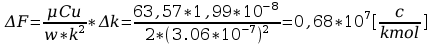
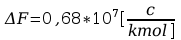
Wyszukiwarka
Podobne podstrony:
Ćw nr 8, sprawozdanie nr 8, Sławomir Leśniak
cw nr 7 prostowniki sterowane t Nieznany
biologia cw nr 6 id 87715 Nieznany (2)
Metrologia cw nr 1 id 297211 Nieznany
SPRAWOZDANIE Z FIZYKI Cw 21 2, Fizyka Sprawozdania, Ćw nr 21
sprawozdanie ćw nr 1(1)
Biofizyka instrukcja do cw nr 0 Nieznany (2)
sprawozdanie cw nr 1
Sprawozdanie Ćw Nr$
Sprawozdanie 21, Fizyka Sprawozdania, Ćw nr 21
Ćw nr 11, 11, Sprawozdanie nr 1
wyznaczanie charakterystyki tranzystora , Sprawozdanie z fizyki nr 2
sprawozdanie nr.1, LABOLATORIUM FIZYKI 1

