ILOCZYN ROZPUSZCZALNOŚCI
z.1. Ile g PbSO4 znajduje się w 200 cm3 nasyconego roztworu tej soli; pKSO = 7,8
PbSO4 ↔ Pb2+ + SO42-
KSO = [Pb2+][SO42-]
x x
Zauważamy, że jest to iloczyn typu x2, więc
x2 = KSO; x=![]()
; x = ![]()
= 0,000126 mol
M PbSO4 = 303 g/mol
1 mol - 303g
0,000126mol - x; x = 0,038g
Ta ilość znajduje się w jednym litrze roztworu, pytamy ile jest w 200 cm3:
0,038g - 1000 cm3
x - 200 cm3 x = 0,00764g
Odp: W 200 cm3 wody rozpuszcza się 0,00764g siarczanu (VI) ołowiu (II).
z. 2. Oblicz rozpuszczalność chlorku ołowiu (II), wiedząc, że pKSO = 4,8
PbCl2 ↔ Pb2+ + 2Cl-
KSO = [Pb2+][Cl-]2
x 2x
Zauważamy, ze mamy iloczyn typu 4x3:
4x3 = KSO, więc x = ![]()
; x = 0,0158 mol
M PbCl2 = 278 g/mol
1mol - 278g
0,0158 mol - x; x = 4,4g
Tyle gramów PBCl2 rozpuszcza się w 1000 cm3 (1000g, bo gęstość dla rozcieńczonych roztworów soli jest równa 1 g/cm3) roztworu. Rozpuszczalność jest to ilość gramów substancji rozpuszczonej w 100 g rozpuszczalnika.
Widzimy, że skoro w 1000g roztworu PbCl2 jest 4,4g tej soli, to wody jest 995,6g, więc
4,4g PbCl2 - 995,6g wody
x - 100g; x = 0,44g
W zadaniach tego typu, ponieważ zwykle bardzo mało soli rozpuszcza się w litrze wody, można masę tej soli pominąć i zrobić następującą proporcję:
4,4 g PbCl2 - 1000g wody
x - 100g x = 0,44g
Zauważamy, że przy zachowaniu dokładności do drugiego miejsca po przecinku wynik jest taki sam.
Odp: W 100g wody rozpuszcza się 0,44g chlorku ołowiu (II).
z. 3.
Która sól i ilokrotnie lepiej jest rozpuszczalna w wodzie: PbSO4 czy PbF2? pKSO PbSO4 = 7,8; pKSO PbF2 = 7,6
Liczymy ilość moli tych soli jaka rozpuszcza się w 1000 cm3 roztworu, a następnie przeliczamy to na masę. Obliczone masy porównujemy.
PbSO4 ↔ Pb2+ + SO42-
KSO = [Pb2+][SO42-] = x2; x = ![]()
= 0,000126
M PbSO4 = 303 g/mol
1 mol - 303g
0,000126 - x; x = 0,038g
PbF2 ↔ Pb2+ + 2F-
KSO = [Pb2+][F-]2
x 2x
Iloczyn typu 4x3
x = ![]()
= 0,0018 mol
M PbF2 = 245 g/mol
1 mol - 245g
0,0018 - x; x = 0,44g
Nie przeliczamy już tego na 100g wody, bo stosunek jednej masy do drugiej jest stały:
0,44g/0,038g = 11,6
Odp: Fluorek ołowiu (II) rozpuszcza się w wodzie 11,6 razy lepiej niż siarczan (VI) ołowiu (II).
z. 4. Oblicz stężenie molowe jonów Ag+ w nasyconym roztworze Ag3PO4, pKSO = 15,8.
Ag3PO4 ↔ 3Ag+ + PO43-
KSO = [Ag+]3[PO43-]
3x x
Zauważamy, że mamy iloczyn typu 27 x4, więc
x = ![]()
= 4,9*10-5 mol
Zauważamy, ze pytanie w zadaniu dotyczy kationów srebrowych, srebrowych nie całej soli. Kationów Ag+ jest 3 razy więcej niż cząsteczek soli, czyli jest ich 3x:
3*4,9*10-5 = 1,48*10-4 mol
Odp: Stężenie jonów srebrowych w nasyconym roztworze ortofosforanu (V) srebra wynosi 1,48*10-4 mol/dm3.
z. 5. Wiedząc, że iloczyn rozpuszczalności Bi2S3, pKSO = 9,7, oblicz stężenia molowe jonów Bi3+ i S2- w nasyconym roztworze tej soli:
Bi2S3 ↔ 2Bi3+ + 3S2-
KSO = [Bi3+]2[S2-]3 = (2x)2(3x)3 = 4x2*27x3 = 108x5
2x 3x
zauważamy, że mamy iloczyn rozpuszczalności typu 108x5, więc:
x = ![]()
= 0,0045 mol
2x = 0,009 mol/dm3; 3x = 0,0135 mol/dm3
Odp: Stężenie molowe jonów Bi3+ wynosi 0,009 mol/dm3, zaś jonów S2- 0,0135 mol/dm3
z.6. Wiedząc, że rozpuszczalność CaF2 wynosi 0,00156g oblicz iloczyn rozpuszczalności.
Zaczynamy od rozpisania równowagi dysocjacji i znalezienia wyrażenia na iloczyn rozpuszczalności:
CaF2 ↔ Ca2+ + 2F-
KSO = [Ca2+][F-]2 = 4x3
x 2x
Rozpuszczalność wyrażana jest w gramach substancji rozpuszczonej w 100g rozpuszczalnika, więc:
0,00156g - 100grozpuszczalnika (100 cm3 roztworu)
x - 1000 x = 0,0156g
(przy tak małych ilościach substancji rozpuszczonej przyjmujemy, bez większego błędu, że 100 g rozpuszczalnika to 100g/cm3 roztworu)
M CaF2 = 76g/mol
1 mol - 76g
x - 0,0156g; x = 2*10-4 mol
To, co obliczyliśmy to jest x z wyrażenia na iloczyn rozpuszczalności, więc:
KSO = 4x3 = 4*(2*10-4)3 = 3,46*10-11; pKSO = 10,46
z. 7. Wiedząc, że iloczyn rozpuszczalności Cd(OH)2 wynosi pKSO = 13,6 oblicz pH nasyconego roztworu tego wodorotlenku:
Potrzebujemy obliczyć stężenie molowe jonów OH-:
Cd(OH)2 ↔ Cd2+ + 2OH-
KSO = [Cd2+][OH-]2 = 4x3
x 2x
x = ![]()
= 1,84*10-5 mol
[OH-] = 2x = 2*1,84*10-5 = 3,69*10-5 mol/dm3
pOH = -log[OH-] = -log(3,69*10-5) = 4,43; pH = 9,57
Odp: pH nasyconego roztworu wodorotlenku kadmu wynosi 9,57
z. 8. Przy jakim pH zacznie się strącać Bi(OH)3 z roztworu Bi(NO3)3 o stężeniu 0,1 mol/dm3? pKSO Bi(OH)3 = 30,4
W roztworze zachodzi reakcja: Bi3+ + 3OH- = Bi(OH)3
Zapisujemy równowagę dysocjacji i wyrażenie na iloczyn:
Bi (OH)3 ↔ Bi3+ + 3OH-
KSO = [Bi3+][OH-]3 = 27x4
x 3x
Wiemy, że w bardzo kwaśnym pH taki wodorotlenek się rozpuści, pytamy jakie jest graniczne pH, przy którym osad Bi(OH)3 zaczyna się wytrącać.
W tym zadaniu pojawia się nowość: znamy stężenie azotanu (V) bizmutu, a co za tym idzie stężenie jonów Bi3+ = 0,1 mol/dm3, więc:
[Bi3+][OH-]3 = KSO
0,1*[0H-]3 = 3,98*10-31
[OH-] = ![]()
= 1,58*10-10
pOH = -log[OH-] = -log(1,58*10-10) = 9,8; pH = 4,2
Odp: Bi(OH)3 zaczyna się strącać przy pH 4,2 z 0,1 M roztworu Bi(NO3)3, czyli poniżej tego pH osad Bi(OH)3 rozpuści się zgodnie z reakcją: Bi(OH)3 + 3H+ = Bi3+ + 3H2O
Uwaga: ja w tym zadaniu zapisałem, ze iloczyn jest typu 27x4, ale w ogóle nie korzystam z tego wyrażenia, bo w tego typu zadaniu jest ono nie potrzebne.
z. 9. Przy jakim stężeniu chlorków zacznie się strącać AgCl z roztworu AgNO3 o stężeniu 0,005 mol/dm3? pKSO AgCl = 9,8
W roztworze zachodzi reakcjia: Ag+ + Cl- = AgCl
Zadanie podobne do poprzedniego:
AgCl ↔ Ag+ + Cl-
KSO = [Ag+][Cl-]
Stężenie jonów Ag+ wynosi 0,005 mol/dm3, więc:
0,005*[Cl-] = 1,58*10-10
[Cl-] = 1,58*10-10/0,005 = 3,2*10-8
Odp: AgCl zacznie się strącać z 0,005 M roztworu AgNO3 jeżeli stężenie chlorków w tym układzie przekroczy 3,2*10-8 mol/dm3
z. 10. Jakie pH roztworu należy zachować w 0,01M roztworze SnCl2, aby nie strącił się w nim osad Sn(OH)2. pKSO Sn(OH)2 = 28,1
W roztworze zachodzi reakcja: Sn2+ + 2OH- = Sn(OH)2
Piszemy wyrażenie na dysocjacje tego wodorotlenku oraz na jego iloczyn rozpuszczalności:
Sn(OH)2 ↔ Sn2+ + 2OH-
KSO = [Sn2+][OH-]2
Znamy stężenie jonów Sn2+ i wynosi ono 0,01 mol/dm3, więc:
0,01*[OH-]2 = 7,94*10-29
[OH-] = 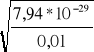
= 8,91*10-14
pOH = -log(8,91*10-14) = 13,05; pH = 0,95
Odp: pH musi być mniejsze niż 0,95
z. 11. Do 50 cm3 roztworu BaCl2 dodano 2 cm3 roztworu H2SO4. Czy strąci się osad BaSO4, jeżeli stężenie obu roztworów wynosiło 0,01 mol/dm3? pKSO BaSO4 = 10
BaCl2 + H2SO4 = BaSO4 + 2HCl
Obliczamy ilości moli obu substancji:
0,01 mol BaCl2 - 1000cm3 ; 0,01 mol H2SO4 - 1000cm3
x - 50 cm3 ; x - 2 cm3
x = 0,0005 mol ; x = 0,00002mol
Teraz postępujemy tak, jakby osad się nie strącił, a tylko roztwory się rozcieńczyły (bo iloczyn rozpuszczalności można liczyć tylko ze stężeń molowych, a nie z ilości moli).
0,0005 mol BaCl2 - 52cm3 0,00002 mol H2SO4 - 52cm3
x - 1000cm3 x - 1000cm3
x = 0,0096 mol/dm3 x = 0,00038 mol/dm3
Teraz piszemy równanie dysocjacji BaSO4 oraz wyrażenie na iloczyn rozpuszczalności:
BaSO4 ↔ Ba2= + SO42-
KSO = [Ba2+][SO42-]
Teraz wstawiamy obliczone stężenia jonów baru i jonów siarczanowych do tego wyrażenia. Jeżeli otrzymany wynik jest większy niż wartość iloczynu rozpuszczalności, to osad się strąci, jeżeli jest mniejszy to osad się nie strąci:
0,0096*0,00038 = 3,69*10-6
Wartość iloczynu rozpuszczalności BaSO4 wynosi 10-10, a więc: 3,69*10-6 > 10-10, czyli osad się wytrąci.
z. 12 Do 20 cm3 nasyconego roztworu chlorku ołowiu zmieszano z 30 cm3 0,01M roztworu chromianu potasu. Czy w tych warunkach strąci się chromian ołowiu? pKSO PbCl2 = 4,8; pKSO PbCrO4 = 13,8.
Obliczam stężenie jonów Pb2+ w nasyconym roztworze chlorku, korzystając z iloczynu rozpuszczalności:
PbCl2 ↔ Pb2+ + 2Cl-
KSO = [Pb2+][Cl-]2 = 4x3
x 2x
x = ![]()
= 0,002 mol
Czyli stężenie jonów ołowiu w nasyconym roztworze PbCl2 wynosi 0,002 mol/dm3
Teraz jak w poprzednim zadaniu obliczam ilości moli substancji w użytych objętościach roztworów przed zmieszaniem, a zmieszanie traktuję jak rozcieńczenie i obliczam nowe stężenia molowe:
0,002 mol Pb2+ - 1000cm3; 0,01 CrO42- - 1000cm3
x - 20 cm3; x - 30 cm3
x = 0,00004 mol x = 0,0003 mol
0,00004 mol Pb2+ - 50 cm3 0,0003 mol - 50 cm3
x - 1000 cm3 x - 1000cm3
x = 0,0008 mol/dm3 x = 0,006 mol/dm3
W układzie zachodzi reakcja:
Pb2+ + CrO42- = PbCrO4
Sól ta dysocjuje pod wpływem wody zgodnie z równaniem:
PbCrO4 ↔ Pb2+ + CrO42-
KSO = [Pb2+][CrO42-]
Teraz podstawiam obliczone powyżej stężenia do wzoru i porównuje z wartością iloczynu rozpuszczalności:
0,0008*0,006 = 4,8*10-6
Iloczyn rozpuszczalności PbCrO4 wynosi 1,58*10-14, więc 4,8*10-6 jest liczbą dużo większą i osad się strąci.
z. 13. 20 cm3 nasyconego roztworu chromianu ołowiu zmieszano z 30 cm3 roztworu chlorku potasu o stężeniu 4 mol/dm3. Czy w tych warunkach strąci się osad chlorku ołowiu? pKSO PbCrO4 = 13,8; pKSO PbCl2 = 4,8
Pytanie jest o osad PbCl2, więc można zacząć od rozpisania jego dysocjacji i rozpisania wyrażenia na iloczyn rozpuszczalności:
PbCl2 ↔ Pb2+ + 2Cl-
KSO = [Pb2+][Cl-]2
Potrzebujemy znać stężenie molowe jonów Pb2+ i Cl-, żeby podstawić to do wyrażenia na iloczyn. Stężenie Pb2+ obliczymy z iloczynu rozpuszczalności drugiej trudno rozpuszczalnej soli ołowiu, zaś Cl- trzeba obliczyć z rozcieńczenia KCl:
PbCrO4 ↔ Pb2+ + CrO4-
KSO = [Pb2+][CrO4-] = x*x = x2
[Pb2+] = x = ![]()
= ![]()
= 1,26*10-7
taka ilość Pb2+ byłaby w 1000 cm3, liczymy ile jest w 20cm3 i jak się to stężenie zmieni po dodaniu 30 cm3 KCl:
1,26*10-7 - 1000 cm3 2,52*10-9 - 50 cm3 roztworu (po dodaniu 30 cm3 KCl)
x - 20cm3 x - 1000 cm3
x = 2,52*10-9 mol x = 5*10-8 mol/dm3
teraz liczymy stężenie Cl- z rozcieńczenia roztworu KCl:
4 mole - 1000cm3 0,12 mol KCl - 50 cm3
x - 30cm3 x - 1000cm3
x = 0,12 mol x = 2,4 mol/dm3
Podstawiamy do wyrażenia na iloczyn:
[Pb2+][Cl-]2 = 5*10-8 * (2,4)2 = 2,88*10-7
KSO PbCl2 = 1,58*10-5, więc: 2,88*10-7 < 1,58*10-5 i osad się nie strąci.
z. 14. Do roztworu otrzymanego przez zmieszanie 30 cm3 NH4NO3 o stężeniu 0,4 mol/dm3 i 20 cm3 NH3aq o stężeniu 0,25 mol/dm3 dodano 0,1 cm3 roztworu chlorku magnezu o stężeniu 1 mol/dm3. Czy strąci się osad Mg(OH)2? K = 1,58*10-5; pKSO Mg(OH)2 = 10,7
Zadanie łączy dwie rzeczy: bufory i iloczyn rozpuszczalności. Trzeba zacząć od rozpisania iloczynu Mg(OH)2:
Mg(OH)2 ↔ Mg2+ + 2OH-
KSO = [Mg2+][OH-]2
Stężenie OH- wyliczamy z pH buforu, stężenie Mg2+ z rozcieńczenia:
pOH = pKB + log(nS/nB)
obliczamy nS i nB:
0,4 mol NH4NO3 - 1000 cm3 0,25 mol NH3 - 1000 cm3
x - 30 cm3 x - 20 cm3
x = 0,012 x = 0,005
pOH = 4,8 + log(0,012/0,005) = 4,8 + 0,38 = 5,18
[OH-] = 10-5,18 = 6,6*10-6 mol
Obliczamy stężenie Mg2+ z rozcieńczenia:
1 mol MgCl2 - 1000 cm3 0,0001 - 50,1 cm3
x - 0,1 cm3 x - 1000 cm3
x = 0,0001 x = 0,002 mol/dm3
Podstawiamy do wyrażenia na iloczyn:
[Mg2+][OH-]2 = 0,002*(6,6*10-6)2 = 8,71*10-14
KSO Mg(OH)2 = 2*10-11; 8,71*10-14 < 2*10-11
Wniosek: Osad się nie strąci
z. 15. Do roztworu o stężeniu 0,01 mol/dm3 względem jonów Ag+ i Bi3+ dodawano kroplami roztwór KI, która sól Agi, czy BiI3 strąci się pierwsza? pKSO AgI = 16,1; pKSO BiI3 19,0.
W tym zadaniu mamy zafiksowane stężenia kationów Ag+ i Bi3+. Wynoszą one 0,01 mol/dm3 i tę liczbę należy podstawić do wyrażenia na iloczyn. Niewiadomą będzie stężenie jonów I-. Ta sól, dla której w tych warunkach [I-] będzie mniejsze strąci się pierwsza,
AgI ↔ Ag+ + I-
KSO = [Ag+][I-]
0,01*[I-] = 7,94*10-17
[I-] = 7,94*10-17/0,01 = 7,94*10-15
BiI3 ↔ Bi3+ + 3I-
KSO = [Bi3+][I-]3
0,01*[I-]3 = 10-19
[I-] = 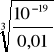
= 2,15* 10-6
Wniosek: 7,94*10-15 < 2,15*10-6, więc AgI strąci się pierwszy
z. 16 Do 10 cm3 roztworu zawierającego 20 mg Ba2+ i 20 mg Pb2+ dodawano kroplami roztwór kwasu siarkowego. Który siarczan strąci się pierwszy? pKSO BaSO4 = 10,0; pKSO PbSO4 = 7,8.
Zadanie bardzo podobne do poprzedniego. Trzeba przeliczyć masy kationów na stężenia molowe.
M Pb2+ = 207 g/mol M Ba2+ = 137 g/mol
1 mol - 207g 1 mol - 137g
x - 0,02g x - 0,02g
x = 9,66*10-5 mol x = 1,46*10-4
Zauważamy, ze te ilości są w 10 cm3, a nam są potrzebne stężenia molowe, czyli obliczone ilości moli trzeba przemnożyć przez 100:
[Pb2+] = 0,00966 mol/dm3 [Ba2+] = 0,0146 mol/dm3
Podstawiamy te stężenia do wyrażeń na odpowiednie iloczyny rozpuszczalności i sprawdzamy, dla którego kationu stężenie [SO42-] wyjdzie mniejsze:
PbSO4 ↔ Pb2+ + SO42-
KSO = [Pb2+][SO42-]
1,58*10-8 = 0,00966*[SO42-]
[SO42-] = 1,58*10-8/0,00966 = 1,64*10-6
BaSO4 ↔ Ba2+ + SO42-
KSO = [Ba2+][SO42-]
10-10 = 0,0146*[SO42-]
[SO42-] = 10-10/0,0146
[SO42-] = 6,85*10-9
6,84*10-9 < 1,64*10-6
Wniosek: Pierwszy strąci się siarczan baru.
z. 17. Podczas analizy kationów I i II grupy analitycznej ołów strącano w postaci chlorku, przy czym stężenie HCl wynosiło 0,01 mol/dm3. Po odwirowaniu osadu do 2 cm3 przesączu dodano 1 cm3 roztworu KI o stężeniu 0,01 mol/dm3. Czy strąci się osad PbI2? pKSO PbCl2 = 4,8; pKSO PbI2 = 8,2.
Trzeba obliczyć stężenie wolnego Pb2+ po strąceniu PbCl2:
PbCl2 ↔ Pb2+ + 2 Cl-
KSO = [Pb2+][Cl-]2
[Pb2+]*(0,01)2 = 1,58*10-5
[Pb2+] = 0,16 mol/dm3
teraz obliczamy stężenia po rozcieńczeniu:
0,16 mol - 1000 cm3 0,00032 mol Pb2+ - 3 cm3
x - 2 cm3 x - 1000cm3
x = 0,00032 x = 0,107 mol/dm3
Teraz obliczamy stężenie jonów I-:
0,01 mol - 1000 cm3 0,00001 mol I- - 3 cm3
x - 1 cm3 x - 1000 cm3
x = 0,00001 mol x = 0,0033 mol
PbI2 ↔ Pb2+ + 2I-
KSO = [Pb2+] [I-]2
[Pb2+][I-]2 = 0,107*(0,0033)2 = 1,19*10-6
KSO PbI2 = 6,3*10-9
1,19*10-6 > 6,3*10-9
Wniosek: W tych warunkach strąci się AgI
Wyszukiwarka