Nr 8 |
Temat: Przepływ prądu przez elektrolity. Wyznaczenie liczb przenoszenia metodą Hittorfa |
Data wykonania 08.06.2009
|
Rok II Grupa 5a
|
Za |
Ocena |
1. Cel ćwiczenia:
Zapoznanie się z przepływem prądu przez elektrolit oraz wyznaczenie liczb przenoszenia metodą Hittorfa.
2. Zagadnienia teoretyczne:
Katoda - nazywamy elektrodę na której zachodzi proces redukcji. W przypadku elektrolizy będzie to elektroda ujemna a ogniwa galwanicznego dodatnia.
Anoda - nazywamy elektrodę na której zachodzi proces utleniania. W przypadku elektrolizy będzie to elektroda dodatnia a ogniwa galwanicznego ujemna.
Przewodniki drugiego rodzaju - przewodzą one prąd dzięki ruchowi jonów , zwane również przewodnikami jonowymi lub elektrolitami (wodne roztwory soli , kwasów i zasad, stopione sole ).
Elektroliza - zespół zjawisk jaki zachodzi podczas przepływu prądu przez przewodnik jonowy.
Elektroda - jest to układ składający się z kontaktującego się ze sobą: przewodnika elektronowego i jonowego.
Stała Faradaja F = N * e
Pierwsze prawo Faradaja - masa substancji wydzielonej lub rozpuszczonej na elektrodzie w czasie elektrolizy jest proporcjonalna do ładunku elektrycznego , który przepływa przez elektrodę
m = k* Q
gdzie : k=R/F - równoważnik elektrochemiczny
Drugie prawo Faradaja - taki sam ładunek elektryczny , przepływając przez różne elektrody , powoduje wydzielenie się lub rozpuszczenie substancji w ilościach chemicznie sobie równoważnych , to znaczy masy tych substancji są proporcjonalne do ich równoważników chemicznych.
Liczba przenoszeń jonów - jest to stosunek ładunku elektrycznego przenoszonego przez dany rodzaj jonów do sumarycznego ładunku elektrycznego przepływającego przez obwód.
3. Wykonanie ćwiczenia
Czyste naczyńko Hittorfa napełniliśmy 0,45M roztworem HCL. Po zamontowaniu obwodu elektrycznego według schematu przez około 1 godzinę przepuszczaliśmy przez obwód prąd elektryczny.
Po zakończeniu elektrolizy wyjęliśmy katodę z kulometru , umyliśmy ją i zważyliśmy . Roztwór z części katodowej wypuściliśmy i zmierzyliśmy jego objętość . Następnie miareczkowaliśmy go 0,005M roztworem NaOH . Miareczkowaniu poddaliśmy również roztwór z części środkowej naczyńka Hittorfa.
1. Tabela wyników miareczkowania NaOH z 5cm3 elektrolitu
Objętość roztworu części katodowej = 41 cm3
Początkowa masa katody = 9,5611g
Końcowa masa katody = 9,6301g
Początkowa masa anody = 5,9295g
Końcowa masa anody = 5,8551g
BADANE ROZTWORY |
I MIARECZKOWANIE [cm3] |
II MIARECZKOWANIE [cm3] |
Roztwór z części katodowej |
33,7 |
33,5 |
Roztwór z części środkowej |
35,5 |
35,2 |
4 . Obliczenia :
Liczba przenoszenia:
![]()
mk =przyrost masy katody kulometru
mk = 9,6301 - 9,5611 = 0,0690g
ma =przyrost masy anody kulometru
ma = 5,9295 - 5,8551 = 0,0744g
Cśr.cz.kat = [(33,7 + 33,5)*0,5 ] cm3 = 33,6 cm3
Cśr.cz.środ = [(35,5 + 35,2)*0,5 ] cm3 = 35,35 cm3
Część katodowa :
0,0336 dm3 --- x moli NaOH
1 dm3 --- 0,05 moli/dm3 NaOH
x = 0,00168 mola
NaOH + HCL NaCL +H2 O
1 mol NaOH zobojętnia 1 mol HCL
nKHCL = nNaOH = 0,00168 mola HCL
CKHCL - stężenie katodowej cz. Naczyńka
![]()
Część środkowa:
nNaOH=0,03535 dm3 * 0.05M =0,0017675 mola
nHCL = nNaOH = 0,0017675 mola
![]()
C = Cśr - Ckat = 0,3535M - 0,336M = 0,0175M
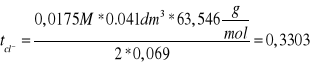
tH+ + tcl- = 1
tH+ = 1 - tcl- = 1 - 0,3303 =0,6697
BŁĄD BEWZGLĘDNY
δi = xi - x0
CNaOH =0,05M + 0,001M = 0,051M
Cz. katodowa :
nNaOH = 0,0336 dm3 * 0,051 M = 0,0017136 moli
nHCL= 0,0017136 moli
CHCL = 0,34272
Cz. środkowa :
nHCL= 0,00180285 moli
cHCL = 0,36057M
cHCL = 0,01785M
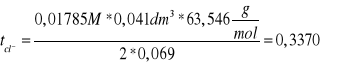
tH+ =1- tcl- = 0,663
δwzględny = (tcl- - cNaOH = 0,051- tcl-)/ tcl- = 0,02028459
δbezwzględny = tcl- - cNaOH = 0,051- tcl- = 0,0067
Cz. katodowa :
nNaOH = 0,0336dm3 * (0,050 - 0,001)M = 0,001646mola
nHCL= 0,001646mola
cHCL = 0,32928
Cz. środkowa :
nHCL = 0,03535 dm3 * (0,050 - 0,001)M = 0,001732 mola
nHCL= 0,001732mola
cHCL = 0,34643
cHCL = 0,01715
tCl- = 0,3187
tH+ = 1-0,3187=0,6813
δwzgl.=(tCl-,cNaOH=0,0499 - tCl-)/ tCl- = (0,3303 - 0,3187) / 0,3187 = 0,03639787
δbezwzględny = 0,0116
W ćwiczeniu mógł również wystąpić błąd miareczkowania i w odczycie objętości zużytego NaOH . Mógł wystąpić również błąd w pipetowaniu.
Wysoka wartość liczby przenoszenia jonów wodorowych jest spowodowany tym że są one bardzo ruchliwe . To z kolei wynika z faktu że jony te są bardzo małe.
(-)Cu| CuSO4 |Cu (+)
Anoda Cu → Cu2+ + 2e
Katoda Cu2+ + 2e → Cu
(-)Ag| AgNO3 |Ag (+)
Anoda Ag → Ag++e
Katoda Ag++e→ Ag
(-)Pt| NaOH |Pt (+)
Anoda 2Cl-+2e →Cl2
Katoda 2H3+O + 2e→ 2H2O + H2
(-)Pt| NaCl |Pt (+)
Anoda 2Cl- →Cl2 + 2e
Katoda Na+ + e→ Na
(-)Pt| H2SO4 |Pt (+)
Anoda 4OH- → O2 + 2H2O + 4e
Katoda 2H3O+ + 2e→ 2H2O + H2
(-)Ni| NaOH |Ni (+)
Anoda 4OH- → O2 + 2H2O + 4e
Katoda 2H3O+ + 2e→ 2H2O + H2
Wnioski :
W wyniku elektrolizy na katodzie osadziła się miedź (więc waga katody wzrosła) . W części katodowej roztworu wydzielił się H2 , a na części anodowej wydzielił się chlor . Ponieważ wyniki miareczkowań roztworu części środkowej i katodowej były zbliżone, świadczy to o dokładności wykonania ćwiczenia .Obliczone (błędy) to również wielkości zbliżone .Liczba przenoszenia jonów dla wodoru jest bardzo wysoka w porównaniu z liczbą przenoszenia jonów dla chloru. Ponieważ masa miedzi osadzona na katodzie jest nieznacznie mniejsza od masy ubytku miedzi na anodzie, możemy wnioskować, że miedź zawierała bardzo małe ilości zanieczyszczeń, które nie wpływały na wyniki pomiarów.
5
Wyszukiwarka
Podobne podstrony:
9-NASZE, AGH, agh, programinski, Laborki, Laborki, Lab, FIZYKA - Laboratorium, przepływ prądu przez
lab f&c nr 9, AGH, agh, programinski, Laborki, Laborki, Lab, FIZYKA - Laboratorium, przepływ prądu p
lab f&c tom, AGH, agh, programinski, Laborki, Laborki, Lab, FIZYKA - Laboratorium, przepływ prądu pr
6Pole magnetyczne wywołane przez przepływ pradu(1)
34. Mechanizm przepływu prądu elektrycznego, Fizyka - Lekcje
Technika skaningowej mikroskopii elektronowej SEM, Uczelnia, Metalurgia
Egzamin - sciagi, 15. Prawa przepływu prądu elektrycznego, 15
„Opisz przepływ pradu elektrycznego elektrycznego w stanie stałym i roztworach wodnych”, Szkoła Stud
2Opisz przepływ pradu elektrycznego elektrycznego w stanie stałym i roztworach wodnych”, Szkoła Stud
cw43, O przepływie prądu elektrycznego mówimy, gdy ładunki elektryczn
Chemia labolatorium, Fiza, Pierwsze prawo Faradaya Masa M wydzielająca się na elektrodzie jest propo
Przepływ energii przez ekosystem
PROCESY NIESTACJONARNEJ WYMIANA CIEPŁA, Uczelnia, Metalurgia
Analiza przepływu wody przez przekrój mostowy (FM)
ćw.10.Badanie właściwości łuku prądu stałego, Elektrotechnika - notatki, sprawozdania, Urządzenia el
Statyczna próba rozciągania - sprawko, Uczelnia, Metalurgia
więcej podobnych podstron