Chowaniec Aleksander 11.03.1996r
Sprawozdanie z ćwiczenia nr 23
Temat:Sprawdzanie praw elektrolizy Faradaya
Zagadnienia do samodzielnego opracowania :
1. Przepływ prądu przez elektrolity.
2. Pierwsze i drugie prawo Faradaya.
Wykonanie ćwiczenia:
Przyrządy:
analityczna waga laboratoryjna, elektrody miedziowe, amperomierz, zasilacz, sekundomierz.
Kolejność czynności:
1. Połączyć obwód według schematu :
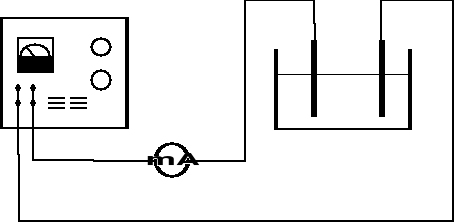
2. Sprawdzić poprawność obwodu elektrycznego zamykając na krótki czas. Równocześnie regulować natężenie prądu w obwodzie, tak aby gęstość nie przekraczała 0,5 A/dm2. (Natężenie prądu wyznaczyć w oparciu o powierzchnie elektrody).
3. Wyjąć katodę, oczyścić starannie papierem ściernym, wypłukać wodą. Wyznaczyć masę m1 katody z analitycznej wagi laboratoryjnej.
4. Umieścić ponownie katodę w elektrolicie, włączyć prąd uruchamiając jednocześnie zegar. Utrzymać stałą wartość natężenia prądu przez czas t = 30 minut.
5. Po upływie tego czasu przerwać przepływ prądu. Opłukać katodę wodą, osuszyć i wyznaczyć masę m2 katody. Masę wydzielonej miedzi obliczyć ze wzoru m = m2 - m1. Przekształcając wzór ![]()
obliczyć równoważnik elektrochemiczny miedzi :
![]()
6. Z układu okresowego pierwiastków odczytać masę atomową miedzi mCu, wartościowość miedzi w = 2 i ze wzoru wyrażającego II prawo Faradaya obliczyć stałą Faradaya :
![]()
7. Wskazówki do opracowania błędów.
Masę miedzi wydzieloną w procesie elektrolizy wyznacza się ważąc katodę na wadze analitycznej przed zamknięciem obwodu i po przerwaniu elektrolizy. Za błąd jakim obarczona jest wydzielona masa miedzi uważać będziemy sumę błędów popełnionych przy obu ważeniach wynikającą z dokładności wagi. Aby osiągnąć dużą dokładność ważenia należy przed przystąpieniem do pomiarów sprawdzić poziome ustawienie wagi oraz wyznaczyć zerowe położenie wskazówki wagi nie obciążonej. Czas trwania elektrolizy mierzy się sekundomierzem. Ponieważ proces trwa 30 minut pomiar czasu można określić z dokładnością do kilkunastu sekund.
I |
m1 |
t |
m2 |
m |
k |
kk |
F |
FF |
[ m A] |
[10-3 kg] |
[ s ] |
[10-3 kg] |
[10-3 kg] |
[g / C] |
[g / C] |
[C/kmo] |
[C/kmol] |
150 |
36,501 |
1800 |
36,5925 |
0,0915 |
0.329 |
|
|
|
Obliczenia :
m = m2 - m1 = 36,5925 - 36,501 = 0,0915 [ g ]
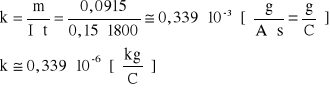
Błędy pomiarów :
błąd pomiaru masy
m1 = m2 = 0,0002 [ g ]
błąd względny
błąd pomiaru czasu
t = 1 [ s ]
błąd względny ![]()
błąd pomiaru prądu
![]()
gdzie k - klasa przyrządu pomiarowego
ZP - zakres pomiarowy
![]()
błąd względny procentowy ![]()
błąd obliczeń równoważnika elektrochemicznego
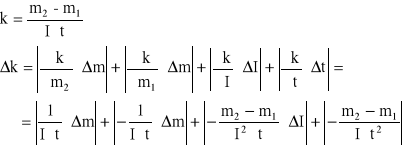
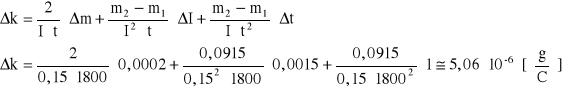
![]()
błąd względny ![]()
błąd obliczeń stałej Faradaya
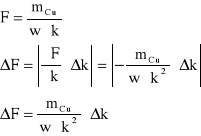
błąd względny
Wnioski :
Celem ćwiczenia było sprawdzenie praw elektrolizy Faradaya. Sprawdzanie tych praw polegało na wyznaczeniu równoważnika elektrochemicznego dla miedzi oraz stałej Faradaya. Równoważnik elektrochemiczny , stała Faradaya ![]()
. Rzeczywiste wartości odczytane w tablicach wynoszą odpowiednio . Przy zastosowaniu przyrządów lepszej klasy ( mierzących z większą dokładnością ) otrzymalibyśmy wartości bliższe rzeczywistym, może nawet równe. Możemy uznać, że sprawdziliśmy prawa Faradaya z pozytywnym wynikiem.
Wyszukiwarka
Podobne podstrony:
586
586 587
bron[586][594]
586
586
586
586
586
instrukcja obslugi 586 686 886
586
586
KSH, ART 586 KSH, IV KK 315/09 - postanowienie z dnia 25 marca 2010 r
SCHEMAT ALARMU MAXICAR 586 786 1286
Zabudowa Akropolu w Jerozolimie 1000 586 r p n e
586
więcej podobnych podstron