CHEMIA ZADANIA
Zadania ze stężeń
Ile wody należy dodać do 100cm3 kwasu azotowego HNO3 o gęstości d = 1,34 g/m3 i stężeniu Cp = 55% aby otrzymać roztwór o stężeniu Cm = 0,1mol/dm3. Kontrakcję pominąć.
Cp stężenie = ms / mv x 100%
Cm = nliczba moli substancji / Vobjętość rotworu
dgęstość = mv / Vr 1,34 g/cm3 = mr / 100cm3
mr = dgęstość x Vr mr = 1,34g/cm3 x 100cm3 = 134g
podstawić do wzoru na Cp:
Cp stężenie = ms / mv x 100% 55% = ms / 134g x 100%
ms = Cp stężenie x mv / 100% ms = 55% x 134g / 100% = 73,7g
MHNO3 = 1+14+48 = 63 g/mol ( masa molowa z tablic )
n = ms / M
n = 73,7 g / 63 g/mol = 1,17 mola
Cm stężenie molowe = n / V mol/dm3
V = n / Cm V = 1,17mola / 0,1mol / dm3 = 11,70dm3 ( objętość końcowa )
11,7dm3 - 0,1dm3 = 11,6dm3
Odp.: 11,59dm3
Ile cm3 Cp = 36% roztworu HCl o gęstości d = 1,18g/cm3 należy rozcieńczyć wodą aby przygotować V2 = 5 dm3 roztworu o stężeniu Cm2 = 0,15 mol/dm3.
Cp = 36% d = 1,18g/cm3 V2 = 5 dm3 Cm2 = 0,15 mol/dm3
V1 = ?
Cm2 = n / V2 0,15mol/dm3 = n / 5dm3 nilość moli = 0,15mol/dm3 x 5dm3 = 0,75mola
MHCL = 1 + 35,5 = 36,5 g/mol ( masa molowa z tablic )
n = ms / M 0,75mola = ms / 36,5 g/mol ms = 0,75g/mol x 36,5g/mol = 27,38g
Cp stężenie = mv substancji / mroztworu x 100%
mroztworu = mv substancji x 100% / Cp stężenie mv = 27,38g x 100% / 36% = 76,06g
dgęstość = mv / Vr 1,18g/cm3 = 76,06g / Vr
Vr = 76,06g / 1,18g/mol = 64,46cm3
Odp. 64,35 cm3
Zadania z iloczynu rozpuszczalności
[AgCl] [Ag+] [Cl-] = Kir = x*x =x2
[PbJ2] [Pb2+] [2j-] = Kir = x*2x2 = 4x3
[CoS] [Co2+] [S2-] = Kir = x*x = x2
W ilu dm3 wody można rozpuścić 0,2 g CaC2O4.
Kir = 2,57*10-9 M =
CaC2O4 → Ca2+ C2O42-
Kir = x*x = x2
x = pierwiastek z Kir
pierwiastek z 2,57*10-9 = 5,0695*10-5
w 1 dm3 → m=x*M = 5,0695*10-5 *M = wynik
wynik - 1dm3
0,2g - x
x = 1dm3 * 0,2g / wynik
W ilu dm3 wody można rozpuścić 0,2g Ć=CaCO3?
Kir = 4,7*10-9 M=100g/mol
CaCO3 Ca2+ +CO2-3
Kir = x*x=x2
![]()
W 1dm3 m=x*M = 6,8557*10-5 *100g/mol = 6,8557*10-3 mol/dm3
0,0068557 mol/dm3 ---- 1dm3
0,2g ----- x
x=1dm3 * 0,2g / 0,0068557mol/dm3 = 0,00137
Zadania z wytrąceniem osadu.
Czy powstanie osad jeżeli zmieszamy ze sobą 100cm3 roztworu NaCl o stężeniu 0,01 mol/dm3 i 150 cm3 Na2SO4?
KiRNa2SO4 = 6,26x10-5
Odp.: Nie wytraci się.
Czy wytrąci się osad CaSO4 gdy 100cm3 CaCl2 o stężeniu 0,1 mol/dm3 i 150cm3NaSO4 o takim samym stężeniu a Kir = 6,26*10-5
CaCl2 + NaSO4CaSO4 + 2NaCl
nCa2+ = nCaCl2 = C*V = 0,01mol/dm3*0,1dm3 = 0,001mol
nSO4 = nNa2SO4 = C*V = 0,01mol/dm3*0,15dm3 = 0,0015mol
po zmieszaniu V=(100 + 150) = 250cm3=0,25dm3
CCa2+ = 0,001/0,25=4*10-3mol/dm3
CSO42- = 0,001/0,25 = 6 *10-mol/dm3
Kir = 4*10-3*6*10-3=2,4*10-5
2,4*10-5<6,16 *10-5
osad się nie wytrąci!!!
Czy powstanie osad jeżeli zostaną zmieszane jednakowe objętości 0,10 molowego Pb(NO3)2 i 0,40 molowego NaCl.
KiR PbCl2 = 1,7x10-5
Odp.: Tak
Zadania z wydajności reakcji
Wwydajność% = masa produktu / masa produktu teoretyczna *100%
3,8g octanu ołowiu Pb(CH3COO)2 rozpuszczono w 30cm3 ciepłej wody destylowanej zakwaszonej CH3COOH
2g KCr2O7 rozpuszczono w 30cm3 wody destylowanej
Suchy osad 3,17g
MK2Cr2O7 = 294g/mol
MPb(CH3COO)2 = 379g/mol
2Pb(CH3COO)2 * 3H2O + K2CrO7 → 2PbCrO4 + 2CH3COOH + 5H2O + 2CH3COOK
n octanu = 3,8g / 379g/mol = 0,01mola
n dwuchromianu = 2g / 294g/mol = 0,007mola
dwuchromianu użyto w nadmiarze
2 mole octanu - 2 mole dwuchromianu
0,01 mola - x
x = 0,01mola
mPbCrO4 = n * M = 0,01mola * 323g/mol = 3,23g
Wydajność reakcji
3,23g - 100%
3,17g - x
x = 97,53%
Zmieszano 20 cm3 etanolu o gęstości 0,8 g/cm3 i 12 g kwasu octowego (CH3COOH). Obliczyć masę powstałego estru jeżeli reakcja przebiegała z 80%.
Ile gram glukozy poddano fermentacji alkoholowej jeżeli w procesie przebiegającym z 88% wydajnością otrzymano 10 dm3 wodnego roztworu etanolu o gęstości 0,81 g/dm3 i stężeniu 90%.
Zadania z PH:
Jakie jest pH roztworu kwasu siarkowego o stężeniu Cm=0,005 mol/dm3.
pH = -log[H+] stężenie molowe jonów H
H2SO4 → 2H+ + SO42-
stężenie [H+] = 2 (liczba jonów H+) x Cm = 2 x 0,005 mol/dm3 = 0,01 mol/dm3
pH = -log 0,01 = 2
Jakie jest pH roztworu zawierającego 0,365 g HCl w 1 dm3?
ms HCL = 0,365g Cm = ? (stężenie molowe) Vr = 1 dm3
Cm = n / Vr n = ms / M M = 36,5
n = 0,365g / 36,5 g/mol = 0,01 mola
Cm = 0,01 mola / 36,5 dm3 = 0,01 mol/dm3
stężenie [H+] = 1 (liczba jonów H+) x Cm = 1 x 0,01 mol/dm3 = 0,01 mol/dm3
pH = -log 0,01 = 2
Obliczyć pH roztworu HNO2 o stężeniu 0,3206 mol/dm3 zdysocjowanego w 5%
HNO2 → H+ + NO2-
[H+] = α * c = 0,05 * 0,3206 mol/dm3 = 0,01603 mol/dm3
pH-H 1,603*10-2 = 2 - 0,2041 = 1,80
Kompleksometria
Obliczenia
NEDTA=NMg2+ CEDTA*VEDTA=CAl2+ + VMg2+ CMg2+=(CEDTA*VEDTA)/Val2+
Musimy dysponować mianowanym roztworem EDTA o dokładnie określonym stężeniu
Masa molowa EDTA 372,24 g/mol
Stężenie molowe roztworu EDTA C = n / V = mnaważki EDTA / Mmasa molowa EDTA * Vkolby =
Masa Mg2+ 24,31g/mol
nEDTA / nMg2+ = 1 / 1
CEDTA * VEDTA / CMg2+ * VMg2+ = 1 / 1 → CMg2+ = CEDTA * VEDTA / VMg2+
Stężenie molowe EDTA
Masa Mg2+
MMg2+ = CMg2+ * MMg2+ * VMg2+
Zadanie 1
Ile procent miedzi zawierała analizowana próbka miedzi po rozpuszczeniu 0,7585g i zamaskowaniu innych składników. Na zmiareczkowanie Cu zużyto 28,9cm3 0,00934 molowego roztworu EDTA.
Masa próbki 0,7585g
M =63,5 g/mol
NCu = NEDTA = CEDTA * VEDTA = 0,00934mo/dm3 * 0,0289dm3 = 2,7*10-4mola
mcu=n*M = 2,7*10-4mola * 63,5g/mol = 0,01714g
C%Cu=(mcu*100%)/mpr =(0,012114*100)/0,7585 = 2,26%
Zadanie 2
Wyrazić twardość wody w stopniach mini molowych i niemiecki jeżeli na zmiareczkowanie próbki 100cm3 wody zużyto 35cm3 EDTA w stężeniu 0,024 mol/dm3
![]()
Cw*Vw= CEDTA*VEDTA
10mmol - 0,5mmol/dm3 10mmol = 2,80N
x - 8,4mol/dm3 x=16,80mmol 16,80mol = x = 47,04N
Zadanie 3
Jaka objętość 0,002 molowego roztworu EDTA została zużyta na zmiareczkowanie próbki wody o objętości wody 500cm3, jeśli jej twardość wody wynosi 50N.
NEDTA = Njonów
0,5mmol/dm3 = 2,80N
x = 50N x = 0,8929mmol/dm3
0,8929*10-3mol/dm3=8,93*10-4mol/dm3
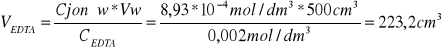
Zadanie 4
Oblicz ile gramów wersanianu sodowego należy rozpuścić w kolbie na 500cm3, aby 103 roztworu EDTA, reagowało z jonami wapnia i magnezu zawartymi w 20cm3 wody o twardości 120mmol.
CEDTA*VEDTA = Cjonów*Vwody
120mmol - x
10mmol - 0,5mmol/dm3 x= 6mmol/dm3 = 0,006mol/dm3
![]()
M=375,24g/mol
m = n * M = CEDTA*VEDTA*MEDTA = 0,012ml/dm3 * 0,5dm3 * 372,24g/mol = 2,2334g
Zadania na 1 punkt:
W jakim stosunku należy zmieszać dwa roztwory, np. 40% i 12% aby końcowy miał 18%.
Cp1 = 40%
Cp2 = 12%
CpK = 18%
mr1 / mr2 = Cp2 - CpK / Cp1 - CpK = 12 - 18 / 40 - 18 = 6 / 22 = 3 / 11
gdyby był roztwór z H2O to 0%
Cp1 Cp2 - CpK
CpK
Cp2 Cp1 - CpK
![]()
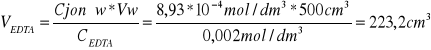
![]()
Wyszukiwarka