ANNA BRACIKOWSKA
EWA CYRANKIEWICZ
OCHRONA ŚRODOWISKA
GRUPA A
ZESPÓŁ IV
ĆWICZENIE NR 2
TEMAT: SPEKTROFOTOMETRIA W ULTRAFIOLECIE - WPŁYW ROZPUSZCZALNIKÓW NA POŁOŻENIE PASMA n - π* W KETONACH.
1. Część teoretyczna
Spektrofotometria jest działem absorpcjometrii, w którym stosuje się przyrządy zwane spektrofotometrami. Dział metod optycznych, wykorzystujących absorpcję ( przez badaną substancję ) promieniowania elektromagnetycznego w nadfiolecie i w zakresie widzialnym nosi nazwę spektrofotometrii UV - VIS. Przedmiotem badań są widma elektronowe.
Prawdopodobieństwo przejść elektronowych między poszczególnymi stanami energetycznymi cząsteczki określają tzw. reguły wyboru, podstawowe są następujące:
aby nastąpiła absorpcja promieniowania, muszą istnieć takie dwa stany kwantowe cząsteczki ψn i ψm, których różnica energii odpowiada energii hv promieniowania padającego:
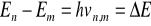
absorpcja promieniowania musi być związana ze zmianą momentu dipolowego cząsteczki μ w sposób liniowy. Warunek ten opisuje tzw. moment przejścia między stanami elektronowymi, określający prawdopodobieństwo absorpcji dopasowanego fotonu:

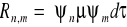
gdzie: Rn,m - moment przejścia
ψn, ψm - elektronowe funkcje stanów, między którymi zachodzi przejście
elektronów
μ - moment dipolowy cząsteczki
dτ - element objętości
Przejście elektronowe dozwolone jest wtedy, gdy Rn,m ≠ 0. Przejścia spełniające reguły wyboru noszą nazwę przejść dozwolonych, a nie spełniające reguł wyboru - przejść wzbronionych.
Rodzaje przejść elektronowych
W związkach organicznych absorpcja promieniowania związana jest z przejściami elektronów walencyjnych ( elektrony δ i π ) oraz elektronów wolnych par elektronowych ( elektrony n ).
Absorpcja promieniowania w UV związana jest z następującymi przejściami elektronowymi:
Orbital δ wiążący → δ* anty wiążący
Orbital π niewiążący → π* anty wiążący
Orbital π niewiążący → δ* anty wiążący
Orbital π wiążący → π* anty wiążący
Wzbudzenie elektronowe następuje wówczas, gdy w wyniku absorpcji promieniowania zachodzi przeniesienie elektronu z orbitalu o niższej energii na wolny orbital o energii wyższej.
Wyróżniamy przejścia: δ → δ* π → π* π → π* π → δ*
Dla prostych cząsteczek przejście δ → δ* wymaga największej energii, a długość fali promieniowania elektromagnetycznego związana z tym przejściem jest mniejsza od 200 nm.
Przejście π → π* i π → π*. Długość fali odpowiadająca tym przejściom leży w zakresie widzialnym i nadfioletowym widma promieniowania elektromagnetycznego.
Przejście π → δ* odpowiadają długości fali przeważnie ok. 200 nm.
Najbardziej charakterystyczna dla zw. karbonylowych jest absorpcja związana z przejściem π→ π*. Przejście to charakteryzuje się m. in. Mała wartością molowego współczynnika absorpcji ( ε ≤ 100 ), niską energią, poza tym pasmo π → π* zanika w środowisku kwaśnym na skutek zablokowania wolnej pary elektronowej heteroatomu. Jako rozpuszczalników używamy najczęściej takich substancji: woda, węglowodory nasycone, alkohole, etery itp.
Rozpuszczalniki mogą wywierać wpływ na widmo substancji rozpuszczonej.
w przypadku gdy substancja nie polarna rozpuszczona jest w rozpuszczalniku nie polarnym, wpływ jest nieznaczny.
W polarnym rozpuszczalniku widmo substancji nie polarnej zmienia się w nieznacznym stopniu w wyniku oddziaływań typu dipol - dipol indukowany.
Największe zmiany w widmie mają miejsce przy rozpuszczeniu substancji polarnej w rozpuszczalniku polarnym. Zmiany te wywołują silne oddziaływania typu dipol - dipol. Pasma π → π*, przy wzroście polarności rozpuszczalników, przesuwają się w stronę fal dłuższych, jednocześnie ich natężenie wzrasta, a pasma π → π* przesuwają się w stronę fal krótszych.
Prawa absorpcji
I prawo absorpcji ( Prawo Bouguera - Lamberta )
Wiązka światła monochromatycznego przy przechodzeniu przez jednorodny ośrodek absorbujący o grubości l ulega osłabieniu według równania: ![]()
gdzie: Io - natężenie wiązki promieniowania monochromatycznego padającego na
jednorodny ośrodek absorbujacy
I - natężenie promieniowania po przejściu przez ośrodek absorbujący
K - współczynnik absorpcji, charakterystyczny dla danej substancji.
W formie logarytmicznej: ![]()
A - zdolność pochłaniania, zwana absorbancją.
Prawo absorpcji ( Prawo Beera ).
W przypadku gdy współczynnik absorpcji rozpuszczalnika jest równy zero, to wiązka promieniowania monochromatycznego, przy przechodzeniu przez jednorodny roztwór substancji absorbującej o stężeniu c, ulega osłabieniu według równania: ![]()
Zależność ta w formie logarytmicznej ma postać: ![]()
Prawo absorpcji ( Prawo addytywności absorpcji )
Absorpcja roztworu wieloskładnikowego równa się sumie poszczególnych składników: A = A1 + A2 + ... + An
gdzie: A1, A2, ...,An - są to absorbancje poszczególnych składników.
Prawo addytywności umożliwia analizę jakościową układów wieloskładnikowych.
W równaniu na absorbancję: ![]()
wielkość a jest właściwym współczynnikiem absorpcji, stężenie wyrażamy w g / cm3.
Natomiast gdy stężenie wyrażamy w molach / cm3, równanie to przybiera postać:
![]()
. Współczynnik ε nazywamy molowym współczynnikiem absorpcji.
2. Obliczenia
Rozpuszczalnikiem w roztworze badanym jest woda.
Z wykresu odczytujemy wartość A ( absorbancję ) dla roztworów wzorcowych:
roztwór A - aceton w heksanie A = 0,65
roztwór B - aceton w alkoholu A = 0,68
roztwór C - aceton w wodzie A = 0,76
Ze wzoru na absorbancję ![]()
obliczamy wartośc ε ( molowego współczynnika absorpcji ) dla acetonu w trzech rozpuszczalnikach ![]()
gdzie: l - grubość kuwety = 1
c - stężenie roztworów = 0,03 mol / dm3
I. ![]()
II. ![]()
III. ![]()
Krzywa wzorcowa Amax = f (c)
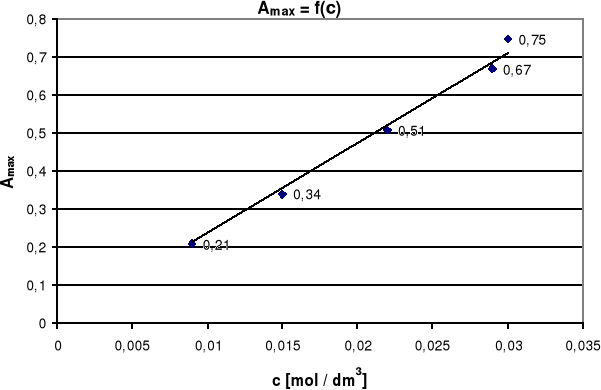
Ze wykresu odczytujemy Amax dla roztworu C o różnych stężeniach:
0,03 mol / dm3 roztwór acetonu w wodzie A = 0,75
I. 0,06 mol / dm3 roztwór acetonu w wodzie A = 0,21
II. 0,12 mol / dm3 roztwór acetonu w wodzie A = 0,34
III. 0,18 mol / dm3 roztwór acetonu w wodzie A = 0,51
IV. 0,24 mol / dm3 roztwór acetonu w wodzie A = 0,67
Obliczamy stężenie tych roztworów i roztworu badanego ze wzoru ![]()
Roztwór acetonu w wodzie ![]()
I. ![]()
II. ![]()
III. ![]()
IV. ![]()
Roztwór badany ![]()
3. Wnioski
Na podstawie krzywych absorpcji roztworów wzorcowych wywnioskowałyśmy, że rozpuszczalnikiem w roztworze badanym jest woda.
Aceton CH3COCH3 daje pasmo związane z przejściem π - π* . Przejście to charakteryzuje się małą wartością współczynnika molowego absorpcji . Rozpuszczalnik wywiera duży wpływ na widmo substancji rozpuszczonej. Rozpuszczając aceton ( substancję polarną ) w wodzie( rozpuszczalniku polarnym ) zachodzą duże zmiany w widmie acetonu. Zmiany te są spowodowane silnym oddziaływaniem dipol - dipol. Pasma π- π* przy wzroście polarności rozpuszczalnika przesuwają się w stronę fal krótszych.
Krzywa wzorcowa Amax = f (c) jest linią prostą , co świadczy o tym, że roztwór acetonu w wodzie spełnia prawo Beera.
Wyszukiwarka