Inżynieria Materiałowa Grupa I |
17 kwiecień 1999/2000 |
Nr zespołu 2
Ćwiczenie nr 12.
Temat: Kinetyka reakcji katalitycznego rozkładu wody utlenionej - kataliza heterogeniczna.
Tomasz Foryś
Wstęp.
W procesach katalizy heterogenicznej katalizator i substraty reakcji tworzą dwie różne fazy. Reakcja jest przyśpieszana na granicy faz. Katalizator wpływa na szybkość reakcji chemicznej, nie posiada natomiast wpływu na równowagę chemiczną. Procesem poprzedzającym reakcję heterogeniczną jest adsorpcja substancji reagujących.
Szybkość rozkładu wody utlenionej wzrasta, jeżeli reagujący roztwór pozostaje w kontakcie z metalami itp. Proces ten przedstawia równanie:
2H2O2 = 2H2O + O2
Jeżeli przyjmiemy, że szybkość tej reakcji na powierzchni katalizatora jest znacznie większa od szybkości dyfuzji H2O2 do powierzchni katalizatora, wtedy szybkość reakcji katalitycznej będzie determinowana przez dyfuzję H2O2. Jeżeli założymy także, że szybkość reakcji rozpadu w masie roztworu jest pomijalnie mała, to ten proces katalityczny możemy opisać równaniem:
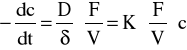
gdzie: -dc/dt - szybkość rozkładu; D - współ. dyfuzji przez warstwę cieczy o grubości δ;
K - współ. proporcjonalności, stały w danej temp.; F - powierzchnia fazowa katalizatora;
V - objętość roztworu; c - stężenie H2O2 w momencie czasu t.
Całkując to równanie obustronnie otrzymujemy:
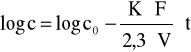
Metody pomiarowe.
Ćwiczenie polegało na wyznaczeniu szybkości rozkładu wody utlenionej bez
i w obecności różnych ilości katalizatora oraz przy różnej intensywności mieszania roztworu. W tym celu wyznaczaliśmy stężenia roztworów H2O2 w różnych punktach czasu, miareczkując próbki roztworem 0,05n KMnO4. Oznaczanie to opiera się na reakcji:
5H2O2 + 2MnO4- + 6H+ = 5O2 + 2Mn2+ + 8H2O. Wynika z niej, że 34,015g H2O2 reaguje z 40000ml 0,05n KMnO4.
Wyniki pomiarów i obliczenia.
a) wyznaczanie cmo roztworu H2O2
Pierwszy pomiar 25ml
Drugi pomiar 24,5ml
Średnia - 24,75 ml KMnO4
Przykład obliczeń:
34,015 [g] H2O2 → 40000 [ml] 0,05n KMnO4
c0 → 24,75 [ml] ⋅100 [1/l]
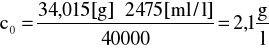
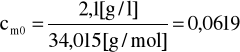
[mol/l]
logcm0 = log 0,0619 = -1,208
b) roztwór stojący bez katalizatora
czas t [min] |
ilość KMnO4 [ml] |
stężenie H2O2 c [g/l] |
stężenie H2O2 cm [mol/l] |
log cm |
30 |
20,2 |
1,72 |
0,0505 |
-1,297 |
70 |
19,8 |
1,68 |
0,0495 |
-1,305 |
Współczynnik wyliczony z komputerowej regresji: 0,0002
c) roztwór stojący z 2,5 ml zawiesiny MnO2
czas t [min] |
ilość KMnO4 [ml] |
stężenie H2O2 [g/l] |
stężenie H2O2 cm [mol/l] |
log cm |
20 |
16,4 |
1,39 |
0,0410 |
-1,387 |
40 |
14,4 |
1,22 |
0,0360 |
-1,444 |
60 |
13,7 |
1,17 |
0,0343 |
-1,465 |
Współczynnik wyliczony z komputerowej regresji: 0,002
d) roztwór mieszany z 2,5 ml zawiesiny MnO2
czas t [min] |
ilość KMnO4 [ml] |
stężenie H2O2 [g/l] |
stężenie H2O2 cm [mol/l] |
log cm |
7 |
18,0 |
1,53 |
0,0450 |
-1,347 |
15 |
17,3 |
1,47 |
0,0433 |
-1,364 |
25 |
16,4 |
1,39 |
0,0410 |
-1,387 |
35 |
15,9 |
1,35 |
0,0398 |
-1,401 |
45 |
15,5 |
1,32 |
0,0388 |
-1,412 |
55 |
15,2 |
1,29 |
0,0380 |
-1,420 |
65 |
14,9 |
1,27 |
0,0373 |
-1,429 |
Współczynnik wyliczony z komputerowej regresji: 0,0014
e) roztwór mieszany z 5 ml zawiesiny MnO2
czas t [min] |
ilość KMnO4 [ml] |
stężenie H2O2 [g/l] |
stężenie H2O2 cm [mol/l] |
log cm |
5 |
17,5 |
1,49 |
0,0438 |
-1,359 |
10 |
16,8 |
1,43 |
0,0420 |
-1,377 |
20 |
15,0 |
1,28 |
0,0375 |
-1,426 |
30 |
14,5 |
1,23 |
0,0363 |
-1,441 |
40 |
13,9 |
1,18 |
0,0348 |
-1,459 |
50 |
13,4 |
1,14 |
0,0335 |
-1,475 |
60 |
13,0 |
1,11 |
0,0325 |
-1,488 |
Współczynnik wyliczony z komputerowej regresji: 0,0023
Wnioski.
1. Na wykresach można zaobserwować wyraźne zwiększenie szybkości reakcji rozkładu wody utlenionej stojącej, jeśli doda się do niej katalizator. Tak samo możemy zaobserwować większą szybkość rozkładu wody utlenionej mieszanej z 5ml katalizatora
w stosunku do mieszanej wody utlenionej z 2,5 ml katalizatora.
2. Zadziwiający jest fakt, że szybkość rozkładu wody utlenionej z 2,5ml katalizatora w roztworze stojącym była większa niż w roztworze mieszanym. Sytuacja ta może być wynikiem tego, że w roztworze stojącym katalizator opadał na dno. Przed pobraniem próbki z tego roztworu, mieszaliśmy roztwór, lecz stopień jego wymieszania nie był tak duży, jak w zlewce, w której roztwór był mieszany ciągle za pomocą mieszadła. W efekcie w stojącej zlewce w miarę upływu czasu pozostawało więcej katalizatora, niż miało to miejsce w roztworze mieszanym, co doprowadziło do tego, że roztwór wody utlenionej w stojącej zlewce rozkładał się szybciej pod wpływem większej ilości katalizatora.
3. Współczynnik -K⋅F/2,3V w zlewce stojącej z 2,5 ml katalizatora jest dziesięć razy większy, niż w stojącej zlewce bez katalizatora. Możemy więc stwierdzić, że istotnie zawiesina MnO2 jest katalizatorem reakcji rozkładu wody utlenionej, wyraźnie przyśpieszającym ten proces. W zlewce bez katalizatora współczynnik ten powinien być równy zero, ponieważ powierzchnia fazowa katalizatora jest w tym przypadku równa zero. Byłoby tak, gdyby woda utleniona rozkładała się tylko pod wpływem katalizatora, lecz oczywiście tak nie jest.
4. Wyznaczone z wykresu wartości logcmo różnią się o około 10% od tej wartości wyznaczonej przy miareczkowaniu roztworu początkowego. Różnica jest taka duża prawdopodobnie dlatego, że miareczkowanie roztworu początkowego wykonaliśmy na początku zajęć. Później rozlaliśmy roztwór wody utlenionej do odpowiednich zlewek
i przez pewien czas przygotowywaliśmy się do sprawnego przeprowadzenia ćwiczenia.
W tym czasie woda utleniona samoczynnie uległa w pewnym stopniu rozkładowi. Gdy dodaliśmy do zlewek katalizator i rozpoczęliśmy wykonywanie ćwiczenia, rzeczywiste stężenie początkowe wody utlenionej w roztworach było niższe niż to, które wyznaczyliśmy na początku.
5. Punkty pomiarowe na wykresie logcm w funkcji czasu nie układają się mniej lub bardziej idealnie wzdłuż linii prostych. Spowodowane jest to tym, że całe ćwiczenie trzeba było wykonywać z dość dużym pośpiechem, co przy takich pomiarach jak miareczkowanie, miało znaczący wpływ na dokładność uzyskanych wyników.
6. Przy dwukrotnym zwiększeniu ilości katalizatora z 2,5ml do 5ml dla roztworów mieszanych, otrzymaliśmy wzrost współczynnika o ok. 1,65 raza. Jednak gdy weźmiemy pod uwagę błędy pomiarowe, możemy stwierdzić z dużą pewnością, że współczynnik ten rośnie proporcjonalnie do ilości katalizatora, a tym samym rośnie proporcjonalnie do jego powierzchni.
Wyszukiwarka
Podobne podstrony:
CHEMIA 12, Chemia fizyczna AGH laborki, lab 12
SPRAWOZ4, Chemia fizyczna AGH laborki, lab 12
CHEMIA 12, Chemia fizyczna AGH laborki, lab 12
SPRAWOZ4, Chemia fizyczna AGH laborki, lab 12
napiecie pow nr 2, Chemia fizyczna AGH laborki, lab 2
LABORKA UKASZ 3, Chemia fizyczna AGH laborki, lab 3,4
korozja dla justyny, Chemia fizyczna AGH laborki, lab 21
Wyniki pomiarów ciepła rozpuszczania, Chemia fizyczna AGH laborki, lab 3,4
SPRAWOZ6, Chemia fizyczna AGH laborki, lab 18
Chemia fizyczna (3, Chemia fizyczna AGH laborki, lab 3,4
lab. 05 - baron, Chemia fizyczna AGH laborki, lab 5
Wykresy do 3, Chemia fizyczna AGH laborki, lab 3,4
tekst 7, Chemia fizyczna AGH laborki, lab 6
Chem 1, Chemia fizyczna AGH laborki, lab 1
skoootaaa, Chemia fizyczna AGH laborki, lab 20
lepkość, Chemia fizyczna AGH laborki, lab 1
Potencjały równowagowe elektrod - siła elektromotoryczna ogniw. polaryzacja, Chemia fizyczna AGH la
więcej podobnych podstron