Adsorpcja - zjawisko występujące na granicy dwóch faz, polegające na powstawaniu różnic pomiędzy przeciętnym składem wnętrza faz, a składem warstw przylegających do powierzchni rozdziału
Zachodzi ono prawie zawsze w przypadku zetknięcia się gazów lub cieczy (adsorbat) z fazą stałą. W wyniku procesu adsorpcji cząsteczki adsorbatu na powierzchni ciała stałego zwanego adsorbentem tracą swobodę ruchu. Oznacza to jednocześnie, że entropia cząsteczek adsorbatu maleje. Maleje również energia swobodna Gibbsa, tzn. ΔG<0. ze związku ΔG = ΔH-TΔS wynika, że również entalpia musi mieć znak ujemny ΔH<0, czyli że wszystkie procesy adsorpcji są egzotermiczne. Między cząsteczkami znajdującymi się w fazie objętościowej (gazie lub cieczy) i cząsteczkami w stanie zaadsorbowanym ustala się stan równowagi dynamicznej, który zostanie osiągnięty, gdy liczba cząstek zaadsorbowanych zrówna się z liczbą cząsteczek ulegających desorpcji (jest to proces odwrotny do adsorpcji).
Schematycznie proces adsorpcji można więc zapisać następująco:
A↔Aads (1)
i wyrazić za pomocą stałej równowagi procesu adsorpcji
![]()
(2)
gdzie aA - aktywność substancji A w fazie objętościowej ,aA.ads aktywność substancji A w stanie zaadsorbowanym.
Równowaga termodynamiczna będzie osiągnięta, gdy potencjał chemiczny substancji A w stanie zaadsorbowanym będzie równy potencjałowi tej samej substancji w fazie objętościowej; musi być zatem spełniony warunek:
μA = μA.ads (3)
Wartości μA i μA.ads zależą od aktywności substancji A. Wzór (3) można więc zapisać następująco:
![]()
(4)
Proste przekształcenia prowadzą do wzoru:
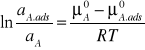
(5)
lub ![]()
(6)
Wyrażenie (6) opisuje liniową zależność pomiędzy aktywnością powierzchniową aA.ads i aktywnością w fazie objętościowej aA. Dla niskich stężeń możemy zamiast aktywności wprowadzić do równania (6) stężenie, wtedy:
ΓA ≡KadsCA (7)
Gdzie: ΓA jest stężeniem w warstwie powierzchniowej, CA - stężeniem w fazie objętościowej
Równanie (7) zwane jest równaniem izotermy adsorpcji Henry'ego. Jest ono spełniane dla niskich ciśnień (poniżej 1 atmosfery) lub dla małych stężeń oraz wyższych temperatur.
W zależności od sił działających na cząsteczki fazy ciekłej lub gazowej warstwie przylegającej do adsorbentu, adsorpcja może mieć charakter fizyczny lub chemiczny. Obydwa te rodzaje adsorpcji znacznie się różnią.
Adsorpcja fizyczna - jest wynikiem oddziaływań międzycząsteczkowych typu van der Waalsa między cząsteczkami adsorbatu i powierzchniowymi cząsteczkami adsorbentu. Jest ona procesem odwracalnym i cechuje ją niewielki efekt cieplny (kilkadziesiąt kJ/mol-1). Cząsteczki substancji zaadsorbowanej mogą tworzyć w tym przypadku warstwę o grubości odpowiadającej kilku średnicom cząsteczek adsorbatu.
Adsorpcja chemiczna - jest wynikiem tworzenia się wiązań chemicznych miedzy cząsteczkami adsorbatu i cząsteczkami powierzchniowymi adsorbentu. Wymaga ona energii aktywacji i charakteryzuje ją z reguły jednocząsteczkowe pokrycie powierzchni adsorbenta. Energia towarzysząca chemisorpcji jest porównywalna z energią reakcji chemicznych i wynosi ok. 102 kJmol. W zależności od rodzaju adsorbatu wiązania chemisorpcyjne mogą być jonowe lub koordynacyjne.
Proces adsorpcji kończy się wraz z ustaleniem stanu równowagi dynamicznej. O ile szybkość adsorpcji jest skomplikowana funkcją wielu parametrów, to opis stanu równowagi układu adsorbent - adsorbat wymaga znajomości trzech wielkości: temperatury, ilości substancji zaadsorbowanej oraz stężenia adsorbatu w fazie ciekłej lub gazowej. W praktyce równowagę adsorpcji bada się przy ustaleniu jednego z parametrów, najczęściej temperatury. Zależność ilości substancji zaadsorbowanej od stężenia równowagowego fazy ciekłej lub gazowej w stałej temperaturze przedstawia się w postaci równania lub graficznie; nazywamy ją izotermą adsorpcji. Wyznacza się ją doświadczalnie, a jej matematyczny opis jest rezultatem teoretycznych rozważań i założeń dotyczących struktury warstwy zaadsorbowanej.
Oprócz izoterm adsorpcji (stała temperatura) znane są izobary adsorpcji (stałe ciśnienie) i izostery adsorpcji (stała ilość substancji zaadsorbowanej).
Odpowiednie równania wyprowadza się z ogólnego równania f(aA, p, T)=0 , określając stan równowagi. Mamy zatem następujące funkcje:
izoterma adsorpcji T=const
aA=f(p)T
izobara adsorpcji p=const
aA=f(T)p
izostera adsorpcji aA=const
p=f(T)aA
Teoria adsorpcji Langmuira
powierzchnia adsorbentu posiada określoną ilość miejsc aktywnych, zwanych centrami aktywnymi,
na jednym miejscu aktywnym może zaadsorbować się tylko jedna cząsteczka adsorbatu,
wiązanie się cząsteczek adsorbatu z miejscem aktywnym może być fizyczne lub chemiczne,
zaadsorbowane cząsteczki tworzą warstwę monomolekularną i nie występują między nimi żadne wzajemne oddziaływania,
cząsteczki nie wykazują ruchu translacyjnego w płaszczyźnie powierzchni adsorbatu,
energia adsorpcji jest stała i nie zależy od stopnia pokrycia powierzchni Θ,
gdy p, T=const. ustala się równowaga między cząsteczkami zaadsorbowanymi na powierzchni a cząsteczkami fazy objętościowej, tzn. że w stanie równowagi liczba cząsteczek adsorbujących się w jednostce czasu równa się liczbie cząsteczek ulegających desorpcji.
Ponieważ na powierzchni adsorbentu występuje skończona liczba miejsc adsorpcyjnych (centrów), stąd też na powierzchni może zaadsorbować się skończona liczba cząsteczek. Stosunek ilości moli zaadsorbowanych na centrach -n do ilości moli odpowiadających obsadzeniu wszystkich centrów aktywnych -nmaks nazywamy stopniem pokrycia
![]()
(8)
Wyszukiwarka