Ćwiczenie nr S-8
Oznaczanie Fe2+ w postaci kompleksu z O-fenantroliną (1,10-fenantroliną)
Celem ćwiczenia jest wykreślenie krzywej absorbcji A = f(λ) , krzywej analitycznej w układzie A = f(c) i określenie zawartości Fe2+ oraz żelaza ogólnego w badanej wodzie.
Opis wykonywanych czynności:
a) przygotowanie roztworów wzorcowych
Do ośmiu kolb miarowych o pojemności 50 cm3 odmierzamy pipetą miarową odpowiednie objętości podstawowego roztworu żelaza o zawartości 0,1mg/cm3 Fe3+ . Do wszystkich dodajemy 10% roztwór chlorowodorku hydroksyaminy ,10% roztwór cytrynianu sodu i 0,25% roztwór o-fenantroliny , a następnie uzupełniamy wodą do kreski. Otrzymaliśmy substancje wzorcowe.
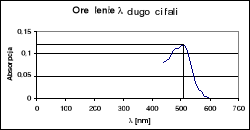
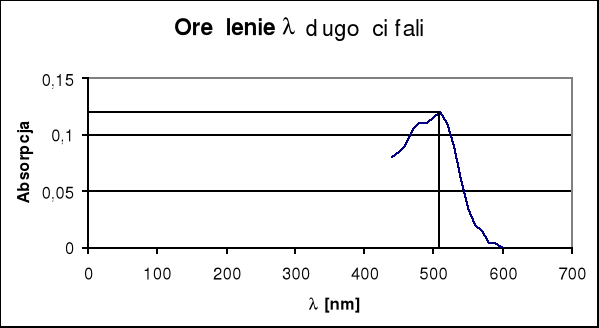
b) sporządzanie wykresu zależności A= f(λ)
Dokonujemy pomiaru absorbancji dowolnego roztworu wzorcowego w zakresie 440-600 nm, zmieniając długość fali co 10 nm , po 10 minutach od dodania wszystkich odczynników. Odnośnikiem jest ślepa próba. Jako analityczną długość fali przyjmuje się maksimum krzywej absorbcji.
c) mierzenie absorbancji roztworów wzorcowych
Mierzenie absorbancji roztworów wzorcowych wykonuje się przy λmax i przy zastosowaniu ślepej próby jako roztworu odniesienia.
d) oznaczanie stężenia jonów Fe2+ w wodzie
Z otrzymanej próbki pobieramy sześć równych prób i przenosimy do kolby miarowej. Do wszystkich dodajemy 10% roztwór chlorowodorku hydrosyaminy ,10% roztwór cytrynianu sodu i 0,25% roztwór o-fenantroliny , a następnie uzupełniamy wodą do kreski. Mierzymy absorbancję badanych roztworów w tych samych warunkach jak dla roztworów wzorcowych.
e) oznaczanie żelaza ogólnego metodą fenontralinową
Z otrzymanej próbki pobieramy do zlewek trzy równe objętości. Do każdej dodajemy wodę destylowaną i 10% roztwór chlorowodorku hydroksyaminy. Ogrzewamy zlewki przez 10 minut w celu redukcji jonów żelaza Fe3+ do Fe2+. Po ostygnięciu przenosimy roztwory do kolbek i dodajemy 10% roztwór chlorowodorku hydroksyaminy ,10% roztwór cytrynianu sodu i 0,25% roztwór o-fenantroliny , a następnie uzupełniamy wodą do kreski. Mierzymy absorbancję badanych roztworów w tych samych warunkach jak dla roztworów wzorcowych.
ORACOWANIA WYNIKÓW
Wykreślenie krzywej analitycznej w układzie A = f(λ)
Położenie maksimum absorpcji wynosi 1,2 , a odpowiadająca jej długość fali λ = 510 nm
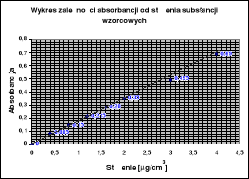
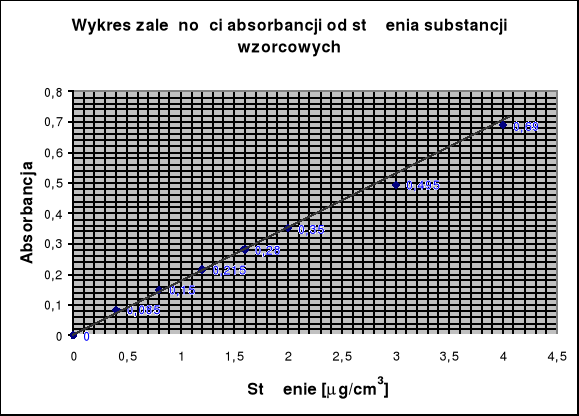
Wykreślenie krzywej analitycznej w układzie A = f(c)
Zawartość żelaza Fe3+ [μg/ cm3] |
0,0 |
0,4 |
0,8 |
1,2 |
1,6 |
2,0 |
3,0 |
4,0 |
|
0 |
0,085 |
0,150 |
0,215 |
0,280 |
0,350 |
0,495 |
0,690 |
Ad.d) Oznaczanie stężenia jonów Fe2+ w wodzie
Próbka |
1 |
2 |
3 |
4 |
5 |
6 |
Absorbancja |
0,315 |
0,265 |
0,260 |
0,265 |
0,260 |
0,270 |
Stężenie |
1,75 |
1,5 |
1,49 |
1,5 |
1,49 |
1,55 |
Stężenia odczytywane są z wykresu.
Stężenia mają miano[μg/ cm3]
Oznaczanie stężenia żelaza ogólnego w badanej próbie
Próbka |
1 |
2 |
3 |
Absorbancja |
0,43 |
0,39 |
0,45 |
Stężenia |
2,40 |
2,20 |
2,45 |
Stężenia odczytywane są z wykresu.
Stężenia mają miano[μg/ cm3]
Dyskusja wyników:
x = x ± t∗sx [ ]
Gdzie:
x =
x - średnia arytmetyczna
xi - poszczególny wynik pomiaru
n - liczba wyników
t - wartość odczytana z tablicy rozkładu t-Studenta
α - przedział ufności
n - liczba prób
k - liczba stopni swobody
sx =
gdzie:
więc:
Obliczam stężenie jonów Fe2+ w wodzie na podstawie równań:
x = 1,54 [μg/ cm3]
s = 1,108 [μg/ cm3]
sx = = 0,044 [μg/ cm3]
x = x ± t∗sx [ ]
k = n-1= 6-1= 5
α = 0,05
t = 2,571
x = 1,54± 2,571*0,0027 = 1,54±0,0069 [μg/ cm3]
Stężenie jonów Fe2+ w wodzie wynosi x = 1,54±0,0069 [μg/ cm3]
Obliczam stężenia żelaza ogólnego w badanej próbie na podstawie równań:
X= 2,35[μg/ cm3]
s = 0,132[μg/ cm3]
sx = = 0,054 [μg/ cm3]
x = x ± t∗sx [ ]
k = n-1= 3-1= 2
α = 0,05
t = 4,303
x = 2,35 ± 4,303*0,035 = 2,35 ± 0,151[μg/ cm3]
Stężenia żelaza ogólnego w badanej próbie wynosi x = 2,35 ± 0,151 [μg/ cm3]
WNIOSKI
Widoczne na wykresie adsorbancji od stężenia niewielkie odchylenia punktów pomiarowych od przebiegu krzywej spowodowane są pewną niedokładnością zarówno przy odczytaniu jak i przy przygotowaniu roztworów wzorcowych. Zwykle błędy precyzji związane z pomiarem absorbancji są znacznie mniejsze niż błędy precyzji popełnione podczas przeprowadzenia operacji chemicznych aż do otrzymania barwnego roztworu.
[μg/ cm3]
s =√
sx =√
Wyszukiwarka