Ćwiczenie nr 30
ILOCZYN ROZPUSZCZALNOŚCI
Celem ćwiczenia jest wyznaczenie iloczynu rozpuszczalności z pomiarów przewodnictwa.
Aparatura i szkło: Odczynniki:
Konduktometr 0,1 M KCl
Wytrząsarka CaSO4 , PbCO3 , BaSO4 ,
Kolbki o poj. 100 cm3 - 6 szt. BaCO3 , PbSO4 , SrSO4
Cylinder do pomiaru przewodnictwa
WYKONANIE ĆWICZENIA:
1. Kalibrowanie konduktometru przed pomiarem:
Przyrząd włączyć do sieci. Przełącznik zakresów pomiarów „Range” ustawić w pozycji 500 μS i nacisnąć przycisk „Cal”. Wskazówka aparatu powinna znaleźć się na podziałce oznaczonej czerwonym trójkątem. W przypadku innego wychylenia należy ustawić ją na tej podziałce za pomocą potencjometru „Calibration”.
2. Wykonanie pomiaru (zasada ogólna):
Oznaczany roztwór umieścić w naczyńku pomiarowym i zanurzyć w nim elektrodę konduktometru. Należy uważać, aby roztwór całkowicie pokrył wszystkie trzy pierścienie platynowe elektrody. Przełącznik zakresów pomiaru przełączyć tak, aby wychylenie wskazówki (najdalej w prawo) umożliwiało odczyt na skali.
3. Pomiar stałej konduktometru:
W sposób opisany w pkt. 2 wykonać pomiar przewodnictwa dla 0,1 M r-ru KCl.
Wartość stałej konduktometru obliczyć ze wzoru:
![]()
,
gdzie: χ - przewodnictwo właściwe 0,1 M KCl,
1/R - wartość przewodnictwa dla 0,1 M KCl, mierzona na konduktometrze,
K - stała konduktometru.
Niektóre wartości przewodnictwa właściwego dla 0,1 M KCl zestawiono w tabeli 1:
Tabela 1.
Tempetatura T [oC] |
Przewodnictwo właściwe S [cm-1] |
18 |
0,01119 |
19 |
0.01143 |
20 |
0,01167 |
21 |
0,02291 |
22 |
0,01215 |
25 |
0,01288 |
4. Wykonać pomiar przewodnictwa dla rozpuszczalnika.
5. Otrzymanie roztworów badanych soli:
Kilka gramów badanej substancji wprowadzić do kolbki o poj. 100 ml, uzupełnić wodą destylowaną i wytrząsać na wytrząsarce przez 10 minut. Następnie roztwór zdekantować, a pozostałość uzupełnić wodą destylowana i ponownie wytrząsać. Czynności te powtarzać aż do momentu uzyskania stałej wartości przewodnictwa. Otrzymany wtedy roztwór ogrzewać w termostacie do temp. 25 oC. Po ustaleniu się równowagi termicznej pobrać próbkę i zmierzyć wartość przewodnictwa.
Wyniki zestawić w tabeli:
Sól |
1/R [Ω-1] |
χ [Ω-1 cm-1] |
c [mol dm-3] |
L |
L lit. |
Błąd pomiaru |
|
|
|
|
|
|
|
OPRACOWANIE WYNIKÓW:
W celu określenia przewodnictwa substancji rozpuszczonej należy od każdej zmierzonej wartości przewodnictwa roztworu odjąć wartość przewodnictwa rozpuszczalnika. Wtedy wartość przewodnictwa właściwego χ można obliczyć ze wzoru:
![]()
Korzystając z literaturowych wartości przewodnictw równoważnikowych jonów oraz z wyznaczonej wartości χ, wyliczyć wartości stężeń roztworów nasyconych ze wzoru:
χ = F (μ+ + μ-) α+ z+ c = F (μ+ + μ-) α- z- c
lub
χ = ( λ+ + λ- ) α+ z+ c = ( λ+ + λ- ) α- z- c ,
gdzie: λ+ , λ- - graniczne przewodnictwo równoważnikowe kationu i anionu,
μ+ , μ- - ruchliwość kationu i anionu,
z+ , z- - ładunek kationu i anionu,
c - stężenie,
F - stała Faraday'a,
α+ , α- - liczba kationów lub anionów otrzymanych w wyniku rozpuszczania
soli w wodzie.
Znając wartość stężenia soli c w roztworze nasyconym, można obliczyć iloczyn rozpuszczalności L z równania:
L = 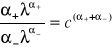
Otrzymane wartości iloczynów rozpuszczalności L badanych soli należy porównać
z iloczynami literaturowymi oraz obliczyć błąd pomiaru.
PRZEPROWADZIĆ DYSKUSJĘ WYNIKÓW.
Wyszukiwarka