BIOKATALIZATORY
ENZYMY - białka naturalne lub modyfikowane
RYBOZYMY - RNA i DNA (kw. rybo- i dezoksyrybonukleinowy)
ABZYMY - przeciwciała posiadające aktywność katalityczną
SYNZYMY - związki syntetyczne (inne biopolimery takie jak oligonukleotydy i oligopeptydy, syntetyczne makrocząsteczki)
ENZYMY
Enzymy są białkami zdolnymi do katalizowania reakcji chemicznych. Miarą aktywności enzymu jest szybkość reakcji katalizowanej. Możliwości katalityczne enzymów wynikają ze zdolności do specyficznego wiązania cząsteczki substratu i stabilizacji stanu przejściowego.
Enzymy mogą być zbudowane z pojedyńczego łańcucha polipeptydowego (np. rybonukleaza) lub z kilku łańcuchów polipeptydowych (chymotrypsyna, fosforylaza glikogenowa), połączonych kowalencyjnie lub niekowalencyjnie. Mogą wymagać obecności koenzymów, tak jak aminotransferazy wymagają obecności fosforanu pirydoksalu, dehydrogenazy - NAD lub FAD, zaś kinazy - cząsteczki ATP. Niekiedy powstaje multienzymatyczny kompleks zbudowany z wielu enzymów i ich koenzymów, wspólnie katalizujących reakcję (np. kompleks dehydrogenazy pirogronianowej zbudowany z trzech rodzajów białek, każdy ze swoim koenzymem, z dwoma dodatkowymi koenzymami i dwoma białkami enzymatycznymi regulującymi aktywność kompleksu). Enzym może mieć kilka centrów aktywnych w jednym łańcuchu polipeptydowym (polimeraza DNA z E. coli, syntetaza kwasów tłuszczowych ssaków).
Centrum aktywne enzymu to fragment powierzchni zbudowany z kilku reszt aminokwasowych. Związany może być w tym miejscu koenzym lub inny niebiałkowy kofaktor współpracujący z częścią białkową, np. jon metalu.
Enzymy katalizują w warunkach umiarkowanych (ciśnienie atmosferyczne, temperatura umiarkowana poniżej 473 K, obojętne pH) i przyspieszają reakcję 106 do 1012 razy. Wykazują specyficzność względem substratu reakcji, specyficzność geometryczną oraz stereospecyficzność (wybierają tylko jeden ze stereoizomerów substratu/produktu). Nie powstają produkty uboczne.
Aktywność enzymów może być regulowana w wyniku modyfikacji kowalencyjnej lub niekowalencyjnej.
Koenzymy to drobnocząsteczkowe związki organiczne, które współuczestniczą w trakcie reakcji katalizowanej. Powstają one z witamin, czyli substancji, których nie syntetyzujemy, ale są niezbędnie potrzebne.
NAD+ to dwunukleotyd nikotynamido-adenylowy (wit. PP, niacyna)
NMN to mononukleotyd nikotynamidowy (wit. PP)
FAD to dwunukleotyd flawino-adenylowy (wit. B2)
Koenzym A (wit.B5)
TPP, DPT to pirofosforan tiaminy - (wit. B1)
PLP to fosforan pirydoksalu (wit. B6)
Biotyna (wit. H)
FH4 - tetrahydrofolian (wit. kwas foliowy)
ATP, CTP, UTP, GTP
S-adenozylometionina
KINETYKA CHEMICZNA
Zanim zaczniemy rozważać kinetykę reakcji katalizowanych enzymatycznie, przypomnijmy sobie podstawowe pojęcia z kinetyki reakcji chemicznej.
A P (reakcja jednosubstratowo- jednoproduktowa)
A + B P
A + B P + Q
AB + CD AC + BD
aA + bB cC + dD
Przebieg reakcji chemicznej (i enzymatycznej) śledzimy z krzywej kinetycznej (progresji, postępu reakcji).
Prędkość reakcji to zmiana stężenia reagentów w czasie:
v = d[P] / dt = - d[A] / dt = k [A]
[A] = [A]o e -kt
Prędkość reakcji I rzędu zmienia się w czasie przebiegu reakcji; prędkość spada w trakcie przebiegu reakcji na skutek zużywania się reagentow. Najwyższa prędkość jest w czasie t =0.
Prędkość tę nazywamy predkościa początkową, v0. Prędkość początkowa jest wyznaczana ze stycznej do krzywej kinetycznej w punkcie gdy t = 0. Jest równa tangensowi kąta między styczną a osią czasu (y/x) w tym punkcie. Prędkość ta jest różna od wyznaczonej wprost z krzywej kinetycznej i dlatego nie powinno się jej tak wyznaczać.
Jedynie w czasie t=0 znamy stężenia substratów reakcji ([A]o).
Dla reakcji I rzędu zależność prędkości początkowej reakcji v0 od początkowego stężenia substratu reakcji [A]0 jest wprost proporcjonalny. Każdy punkt tej krzywej powstaje z krzywej kinetycznej
Dla reakcji 0-go rzędu obserwuje się prostoliniową krzywą kinetyczną (v = v0 = const). Natomiast krzywa zależności vo reakcji od [A]o jest pozioma.
v = k c0 = k.
RÓWNOWAGA REAKCJI CHEMICZNEJ
Dla reakcji:
mA + nB pC + rD
Q = ([C]p. [D]r) / ([A]m. [B]n) - poza stanem równowagi
K = ([C]p. [D]r) / ([A]m. [B]n) - w stanie równowagi
ΔG = ΔGo + RT ln Q
gdzie: ΔGo = -RTlnK
W stanie równowagi:
ΔG = 0 i Q = K
więc
0 = - RTlnK + RTlnK
gdy ΔG (zmiana energii swobodnej) mniejsza od 0, reakcja zachodzi samorzutnie,
gdy ΔG (zmiana energii swobodnej) większa od 0, reakcja nie zachodzi samorzutnie,
gdy ΔG (zmiana energii swobodnej) równa 0, reakcja jest w stanie równowagi.
Powodem niskich szybkości większości reakcji, w których biorą udział substancje organiczne, jest wysoka bariera energetyczna, którą cząsteczki musza pokonać (energia aktywacji). W roztworach wodnych duża część tej energii potrzebna jest na odsuniecie płaszcza wodnego otaczającego reagenty.
AB + CD ABCD ACBD AC + BD
Ea - energia aktywacji to taka ilość energii, jaką należy dostarczyć 1 molowi substratu, aby uzyskać 1 mol kompleksu aktywnego.
KATALIZATOR
Katalizatorem nazwiemy taką substancję K, która tworzy kompleks aktywny (ABCDK) o niższej energii aktywacji niż kompleks bez niego (ABCD).
AB + CD + K ABCDK ACBDK AC + BD + K
Katalizator:
bierze udział w reakcji katalizowanej (tworząc kompleks typu kowalencyjnego lub niekowalencyjnego),
nie zużywa się w trakcie reakcji katalizowanej,
nie może przeprowadzić reakcji termodynamicznie niemożliwej,
nie zaburza równowagi reakcji katalizowanej (nie zmienia stałej równowagi reakcji, K),
skraca czas osiągnięcia równowagi reakcji.
KATALIZA ENZYMATYCZNA
Dopasowanie struktury enzymu i substratu:
* „Klucz i zamek”
Indukowane zmiany struktury
MECHANIZM DZIAŁANIA ENZYMÓW
Kataliza kwasowo zasadowa.
Kataliza kowalencyjna
Kataliza za pomocą jonów metali
Kataliza elektrostatyczna
Efekty zbliżenia i orientacji
Ułatwione wiązanie kompleksu przejściowego
MECHANIZM REAKCJI KATALIZOWANEJ ENZYMATYCZNIE
(na przykładzie reakcji katalizowanej przez chymotrypsynę)
KINETYKA ENZYMATYCZNA
Kinetyka hiperboliczna reakcji z jednym substratem
S P
Michaelis i Menten w 1913 przyjęli, ze reakcja enzymatyczna przebiega z utworzeniem kompleksu aktywnego.
E + S ES E + P.
Reakcja enzymatyczna, to złożony układ składający się z kilku pośrednich reakcji (o różnych stałych szybkości).
Kompleks ES tworzy się z szybkością v+1 + v-2, i rozkłada z szybkością v-1 + v+2.
W stanie równowagi hiperbola przedstawia zależność prędkości początkowej reakcji katalizowanej enzymatycznie od stężenia substratu przy stałym stężeniu enzymu. Wyrażona ona jest wzorem Michaelisa-Menten:
v0 = Vmax [S]0 / (Km + [S]0) = k+2 [E][S]0 / (Km + [S]0)
Na krzywej Michaelisa-Menten przy niskich stężeniach substratu obserwuje się kinetykę pseudo-pierwszego rzędu (proporcjonalność), zaś przy wysokich stężeniach, kinetykę pseudo-zerowego rzędu. Badania aktywności enzymów powinno się wykonywać w tym wysokim zakresie stężeń substratu.
Z wykresu MM wyznacza się stałe Km i Vmax, a następnie kkat i skuteczność.
Km - stała Michaelisa to takie stężenie substratu, dla którego prędkość reakcji jest równa połowie prędkości maksymalnej. Jest miarą powinowactwa enzymu do substratu. Czym mniejsze jest Km, tym większe jest powinowactwo.
Vmax - prędkość maksymalna reakcji - to najwyższa prędkość reakcji przy danym stężenie enzymu, do której asymptotycznie zdążają prędkości początkowe gdy stężenie substratu zmierza do nieskończoności (nie jest to stała).
k+2 = kkat = Vmax / [E] = stała katalityczna = liczba obrotów = reaktywność
Aktywność enzymu przy danym stężeniu substratu zależy od wartości obu stałych.
Skuteczność = kkat / Km
Enzymy różnią się specyficznością wobec różnych substratów.
Z hiperboli Michaelisa-Menten nie jest możliwym precyzyjne wyznaczenie Vmax, gdyż jest to wartość asymptotyczna, do której zmierza prędkość reakcji (i nigdy nie osiąga). Nie jest możliwym również wyznaczenie 1/2 Vmax, aby wyznaczyć Km.
Lineweaver i Burk przedstawili matematyczną metodę przekształcenia równania M-M w prostą, poprzez odwrócenie zmiennych; i umożliwienie precyzyjnego wyznaczenia stałych Km i Vmax, a z nich kkat i skuteczności.
1/vo = 1/Vmax + Km/Vmax · 1/[S]o
Zależność aktywności enzymu od stężenia enzymu (zgodnie z równaniem M-M) jest prostoliniowa (pierwszego rzędu).
Na aktywność enzymu (czyli szybkość reakcji katalizowanej) maja wpływ różne czynniki:
temperatura,
pH i skład buforu,
siła jonowa roztworu,
obecność aktywatorów i inhibitorów.
Wpływ pH:
Wpływ temperatury:
Sposoby wyrażania aktywności enzymatycznej
1961:
U (jednostka standardowa aktywności) to taka ilość enzymu, która katalizuje przemianę 1 mikromola substratu w temperaturze 30oC w ciągu 1 minuty w warunkach optymalnych (pH, skład buforu) przy wysyceniu enzymu substratem.
1972:
katal to aktywność enzymu przekształcająca 1 mol substratu w temp 30oC w ciągu 1 sek w warunkach optymalnych (pH, skład buforu) przy wysyceniu enzymu substratem.
Stężenie enzymu
dla enzymów czystych:
stężenie molowe (mol/l)
dla enzymów nieoczyszczonych:
U/l lub katal/l
Aktywność właściwa
katal/ kg lub U/mg
INHIBITORY
są to substancje, które obniżają aktywność enzymów (czyli szybkość reakcji katalizowanej).
inhibitorY odwracalnE
INHIBITORY KOMPETYCYJNE
B. INHIBITORY NIEKOMPETYCYJNE
ANALOGI STANU POSREDNIEGO
A. INHIBITORY KOMPETYCYJNE - związki, które konkurują z substratem o wiązanie z centrum aktywnym enzymu. Są one zazwyczaj podobne strukturalnie do substratu.
E + S ES E + P.
E + I EI
Działanie wielu leków opiera się na kompetycyjnym hamowaniu enzymów.
Np. dla hamowania wzrostu bakterii wykorzystywana jest konkurencja sulfanilamidu i pokrewnych sulfonamidów z 4-amino-benzoesanem o syntetazę kwasu foliowego.
Np. kompetycyjne hamowanie reduktazy dihydrofolianowej przez takie antybolity jak analogi dihydrofolianu: aminopteryne i metotroksan jest podstawa chemioterapii pewnych nowotworów.
B. INHIBITORY NIEKOMPETYCYJNE:
E + S ES E + P
+I +I
EI ESI
W przypadku hamowania niekompetycyjnego hamowanie nie może być zniesione przez wysycenie substratem. Inhibitor wiąże się z enzymem w innym miejscu niż substrat i utworzony kompleks EIS nie pozwala na utworzenie produktu, lub pozwala w niewielkim stopniu.
Inhibitor prowadzi do takiej zmiany konformacji białka, ze proces katalizy jest częściowo zahamowany.
Czułe inhibitory odwracalne działają hamująco przy stężeniach podobnych do stężenia enzymów (b. niskie). Takie czułe działanie wykazuje:
pepstatyna, inhibitor pepsyny,
allopurynol, inh. oksydazy ksantynowej,
metotreksat, inh. reduktazy dihydrofolianowej.
ANALOGI STANU POSREDNIEGO
np. 2-fosfoglikolan; inh. izomerazy trozofosforanowej
INHIBITORY NIEODWRACALNE
A. NIESPECYFICZNE
B. SPECYFICZNE
skierowane na centrum aktywne
substraty-samobójcy
Są to substancje które mogą tworzyć połączenia kowalencyjne z enzymem. Należą do nich substancje alkilujące, acylujące i fosforylujące
NIESPECYFICZNE:. Działają poza centrum aktywnym enzymu.
SPECYFICZNE:
skierowane na centrum aktywne -
* posiadające strukturę podobną do substratu lub koenzymu
np. pochodne chlorometyloketonowe różnych aminokwasów hamujące enzymy z seryną lub cysteiną w centrum aktywnym;
nie posiadające struktury podobnej do substratu
np. diisopropylfluorofosforan jako inh. chymotrypsyny
substraty-samobójcy - modyfikują one kowalencyjnie grupy centrum aktywnego lub koenzymu po zajściu przemiany katalizowanej enyzmatycznie. Są one idealne w farmakologii.
E + S ES EX* E + P.
I
EX (Nieaktywny)
np. dla proteaz: N-nitrozo-peptydy,
dla transaminaz: beta-halogeno-aminokwasy ( wzrost Diplococcus pneumonie jest hamowany przez -bromo-D-alaninę)
Hamowanie substratem
AKTYWATORY
substancje zwiększające aktywność enzymów. Większość z nich działa poprzez zmianę konformacji enzymów.
Kowalencyjne
B. Niekowalencyjne
Kowalencyjne
np. aktywacja enzymów z grupa tiolową za pomocą odczynników reagujących z nimi,
np. fosforylacja reszty seryny, treoniny lub tyrozyny,
Niekowalencyjne
np. jony metali lub nukleotydy jako ligandy
REGULACJA AKTYWNOŚCI ENZYMÓW
Wiele enzymów jest funkcjonalnie zintegrowanych w szlaki metaboliczne. Istnieje zależność między produktami jednych szlaków a aktywnością metaboliczną innych szlaków.
Np. glukoza z diety może być zamieniana albo w glikogen, albo w tłuszcz, albo w pewne aminokwasy, lub może być utleniona do dwutlenku węgla. W każdym przypadku glukoza zamieniana jest w inny produkt końcowy, w wyniku działania szlaku metabolicznego składającego się z wielu enzymów, z których każdy katalizuje tylko jedną reakcję. Po posiłku, istnieje nadmiar glukozy w układzie, lecz nie jest ona w równym stopniu zamieniana w każdy z wymienionych produktów końcowych. Istnieje precyzyjnie kontrolowany mechanizm homeostazy, który za cel ma utrzymanie stałego poziomu glukozy krwi, zużyć glukozę potrzebną dla dostarczenia energii, utrzymać zapasy glikogenu, i zamienić glukozę w tłuszcz, o ile pozostanie ona w nadmiarze.
Nie wszystkie szlaki metaboliczne działają cały czas z maksimum wydajności. Wiele z nich jest wyłączonych podczas pewnych faz życia komórki. Gdyby tak nie było, to nastąpiłby nieograniczony, niekontrolowany i nieekonomiczny wzrost komórki.
Kontrola regulacji metabolicznej może zachodzić poprzez modulację aktywności enzymatycznej jednego lub kilku kluczowych enzymów szlaku metabolicznego. Chociaż skuteczność szlaku metabolicznego zależy od aktywności wszystkich enzymów szlaku, to szlak może być kontrolowany przez jeden z enzymów, limitujący szybkość szlaku. Zazwyczaj tym kontrolującym szybkość enzymem jest pierwszy enzym szlaku.
Aktywność enzymu może być regulowana na wiele sposobów.
Po pierwsze: absolutna ilość enzymu może być regulowana przez stymulację substratem lub hormonalną stymulację biosyntezy enzymu de novo. Hormony mogą również stłumić biosyntezę enzymu.
Po drugie: aktywność może być modulowana przez aktywatory, inhibitory i przez kowalencyjną modyfikację.
Po trzecie: przez kompartmentyzację, przez rozdzielenie szlaku od jego substratów i przez kontrolę dostępu substratu do enzymów szlaku.
Kompartmentyzacja przeciwnych szlaków maksymalizuje ekonomię komórki
Zazwyczaj szlaki kataboliczne i anaboliczne znajdują się w oddzielnych przedziałach. Gdyby degradacja i synteza kwasu tłuszczowego zachodziły w tym samym miejscu, to byłby to proces próżny. Przez fakt ze synteza kwasu zachodzi w cytoplazmie, a beta-oksydacja w mitochondrium, to może istnieć kontrola przez regulacje transportu intermediatów przez błonę mitochondrialną.
Stężenie enzymu w komórce jest kontrolowane
Prędkość reakcji jest proporcjonalna do stężenia enzymu. Wiele enzymów regulacyjnych i ograniczających szybkość występuje w niewielkim stężeniu. Następna porcja enzymu może zostać zsyntetyzowana po aktywacji mechanizmu kontrolującego ekspresję genu działaniem hormonów. Np. insulina jest hormonem anabolicznym, który indukuje syntezę glukokinazy, fosfofruktokinazy, kinazy pirogronianowej i syntetazy glikogenowej.
W pewnych przypadkach substrat może zahamować syntezę enzymu, np. glukoza hamuje syntezę karboksylazy pirogronianowej.
Wiele enzymów ma krotki czas życia.
Modulacja aktywności enzymatycznej jest regulacją krótkoterminową
Regulacja na poziomie genu jest regulacja długoterminową. Regulacja krótkoterminowa zachodzi przez modyfikacje aktywności istniejącego enzymu działaniem kilku mechanizmów. Podczas różnych faz cyklu komórki specyficzne szlaki metaboliczne są włączane bądź wyłączane, w zależności od zapotrzebowania. Taki typ kontroli to inhibicja przez sprzężenie zwrotne ujemne. Inhibicja taka może być albo typu kompetycyjnego albo allosterycznego. W każdym z tych przypadków Km może wzrosnąć powyżej wartości stężeń substratu in vivo i reakcja zmniejsza szybkość.
Oprócz sprzężenia zwrotnego wewnątrz szlaku metabolicznego, zachodzi sprzężenie zwrotne na innych szlakach, co nazywane jest regulacją poprzeczną (cross-regulation). Produkt jednego szlaku jest inhibitorem lub aktywatorem innego szlaku.
Ponadto zachodzi hamowanie lub aktywowanie enzymów za pomocą modyfikacji kowalencyjnej.
Pewne enzymy są regulowane przez modyfikację kowalencyjną
Odwracalna kowalencyjna modyfikacja to fosforylacja/defosforylacja, adenylacja/deadenylacja, acetylacja/deacetylacja, lub metylacja/demetylacja.
Fosforylacja reszty seryny, treoniny lub tyrozyny zachodzi działaniem enzymu kinazy, a dawcą reszty fosforanowej jest kinaza białkowa, zaś defosforylacja reszt fosfoseryny, fosfotreoniny lub fosfotyrozyny zachodzi działaniem fosfatazy fosfoproteidowej. Aktywność kinaz białkowych z kolei może być zależna od cAMP lub Ca++.
Regulacji przez odwracalną fosforylację podlegają enzymy o kluczowym znaczeniu w przemianach komórkowych. Występują one w dwu postaciach ufosforylowanej i nieufosforylowanej. Różnią się one znacznie aktywnością.
Allosteryczna kontrola aktywności enzymów
Aktywność wielu enzymów jest modulowana działaniem ligandów działających inaczej niż kompetycyjne i niekompetycyjne inhibitory. Ligand jest cząsteczka wiążąca się z białkiem (drobnocząsteczkowa jak ATP, lub białko). Ligand może być aktywatorem, inhibitorem lub substratem enzymu. Te z ligandów, które nie ulegają przemianie w trakcie reakcji nazywamy efektorami. Większość enzymów regulowanych działaniem ligandu to enzymy kluczowe szlaków metabolicznych.
Enzymy allosteryczne oprócz centrum aktywnego mają miejsce wiązania efektora, centrum allosteryczne. Wiązanie allosterycznego efektora powoduje zmianę konformacyjną enzymu tak, że zmienia się powinowactwo enzymu do substratu lub innego liganda. Dodatni efektor allosteryczny powoduje zwiększenie powinowactwa do substratu (ligandu), a ujemne efektory obniżają.
Enzymy allosteryczne dzielimy na dwie klasy w zależności od tego czy efektor działa na K0,5 czy też na Vmax. Czy też na oba równocześnie.
Większość enzymów allosterycznych jest białkami oligomerycznymi, czyli jest zbudowanych z kilku podjednostek (protomerów). Protomer może być zbudowany z kilku łańcuchów polipeptydowych. Wiązanie ligandu do jednego z protomerów może wpływać na wiązanie ligandu do innego protomeru. Takie efekty nazywamy homotropowe. Jeśli jeden ligand wpływa na wiązanie innego ligandu to efekt taki nazywamy heterotropowym.
Enzymy allosteryczne wykazują kinetykę sigmoidalną, czyli niehiperboliczną. Wykres ten jest opisany równaniem Hilla.
Amplifikacja sygnałów regulacyjnych
W układach biologicznych wiele cząsteczek sygnałowych takich jak hormony, które funkcjonują w komunikacji miedzy organami występują w niewielkim stężeniu, lecz wykazują ogromne działanie na organ docelowy. Sygnał generowany przez małą ilość hormonu jest zwielokrotniany w wyniku amplifikacji.
Istnieją 4 podstawowe sposoby regulacji aktywności enzymatycznej
Kontrola allosteryczna:
Stymulacja i hamowanie przez białko regulacyjne
„Odwracalna” modyfikacja kowalencyjna
Aktywacja przez proteolizę
ENZYMY ALLOSTERYCZNE
Dla enzymów o kinetyce MM (hiperbolicznych) możliwa jest prosta regulacja aktywności enzymu poprzez dostarczanie substratu, poprzez inhibitory oraz aktywatory.
Enzymy regulacyjne pracują w miejscach kontroli metabolizmu. Składają się najczęściej z wielu podjednostek.
Wiele enzymów nie wykazuje kinetyki hiperbolicznej MM. Enzymy o kinetyce niehiperbolicznej występują podobno częściej niż enzymy o kinetyce hiperbolicznej.
Dla nich krzywa szybkości reakcji względem stężenia substratu jest sigmoidalna. Wskazuje na istnienie wielokrotnych i współdziałających aktywnych miejsc na enzymie do wiązania substratu. Związanie substratu w jednym miejscu powoduje zmiany w białku, co zwiększa powinowactwo substratu do pozostałych wolnych miejsc. Równanie Hilla opisuje zależność dla enzymów i innych procesów kooperacyjnych, jak wiązania tlenu do Hb:
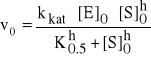
W równaniu Hilla h oznacza ilość miejsc zdolnych do wiązania substratu, czyli współczynnik interakcji, zaś K0.5 - stała połowicznego wysycenia (analogiczna do stałej Km w równaniu Michaelisa-Menten). Szybkość reakcji wzrasta do potęgi h przy wzroście stężenia substratu.
Główną przyczyną występowania kinetyki niehiperbolicznej są efekty spowodowane oddziaływaniami pomiędzy miejscami katalitycznymi oraz miedzy miejscami katalitycznymi i miejscami efektorowymi. Dodatkowa przyczyna kinetyki niehiperbolicznej mogą być ponadto oddziaływania miedzy podjednostkami, dysocjacja oligomeru, asocjacja protomerów lub powolna izomeryzacja protomerów.
Kooperacja- współdziałanie kilku elementów struktury (centrum, protomeru) powodujące ze właściwości katalityczne oraz fizykochemiczne zależą od siły tych oddziaływań.
Kooperacja dodatnia powoduje, że wiązanie jednego reaktanta zwiększa siłę wiązania następnego. Skutkiem tego zjawiska jest sigmoidalna krzywa wysycenia.
Kooperacja ujemna powoduje obniżenie siły wiązania następnego reaktanta. Krzywa wysycenia ma większy obszar plateau niż klasyczna hiperbola.
Procesy kooperacyjne sa podstawa zjawiska allosterii. Allosteria jest pojęciem węższym. Enzymy allosteryczne zaliczamy do enzymów kooperatywnych.
Kinetyka enzymów oligomerycznych
Model sprzężony Monoda Wymana Changeaux (MWC)
Enzym zbudowany jest z symetrycznie ułożonych podjednostek, a każda w dwu stanach : R (relaxed) i T (tense).
Przejście konformacyjne zachodzi równocześnie we wszystkich protomerach (ma charakter sprzężony) i mogą mu ulegać tylko cząsteczki bez reaktanta. Powinowactwo R do reaktanta jest większe niż T.
R T
stała równowagi sprzężonej: L = T/R
Model sekwencyjny Koshlanda Nemethyego Filmera (AKNF)
Istnieją dwa stany konformacyjne protomerów. Tylko podjednostki w stanie B mogą wiązać reaktanta. W roztworze są zatem: A i BR.
Zmiany konformacyjne wywołane związaniem cząsteczki reaktanta prowadza do oddziaływań danego protomeru z protomerami sąsiednimi.
BIOKATALIZATORY
ENZYMY - białka naturalne lub modyfikowane
RYBOZYMY - RNA i DNA (kw. rybo- i dezoksyrybonukleinowy)
ABZYMY - przeciwciała posiadające aktywność katalityczną
SYNZYMY - związki syntetyczne (inne biopolimery takie jak oligonukleotydy i oligopeptydy, syntetyczne makrocząsteczki)
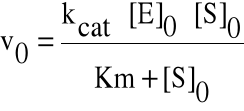
(1)
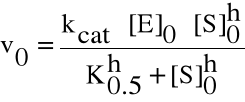
(2)
20
Wyszukiwarka
Podobne podstrony:
ENZYMY !!, studia, biochemia
enzymy;), studia, biochemia
enzymy[1], STUDIA, biochemia
ENZYMY !!, studia, biochemia
ENZYMY SEMINARIUM, Studia, Biochemia
Enzymy, Studia, 1-stopień, inżynierka, Ochrona Środowiska, Biochemia
ENZYMY prezentacja biochemia
Chromatografia podzialowa, Studia, Biochemia i biologia molekularna
Egzamin fizjologia 15, studia, biochemia, FIZJOLOGIA
Kolo biochemia KOMPLET NOTATEK AMINOKWASY, Szkoła Rolnictwo studia, Szkoła, Materiały studia, bioche
bio spis, studia, biochemia
Enzymy1, Studia II rok, Studia, PD materialy donauki, PD materialy donauki
zmydlanie tłuszczy, studia, biochemia
Wykład 4 biochemia enzymy, KOSMETOLOGIA, Biochemia
enzymy, Studia II rok, Studia, PD materialy donauki, PD materialy donauki
instrukcja na kolorymetrię, STUDIA, biochemia
więcej podobnych podstron