1.WSTĘP TEORETYCZNY
Gaz doskonały jest to wyidealizowany stan materii, spełniający następujące warunki:
- cząsteczki gazu zachowują się jak jednorodne kule doskonale sprężyste, będące w stanie ciągłego ruchu postępowego, a zderzenia między nimi zachodzą według praw mechaniki zderzeń sprężystych,
- cząsteczki nie oddziaływają na siebie do momentu zderzenia; zostaje więc zachowany prostoliniowy charakter ruchu cząsteczek między zderzeniami, a żaden kierunek ruchu nie jest uprzywilejowany,
- objętość własna cząsteczek jest znikomo mała i może być zaniedbana w stosunku do objętości zajmowanej przez gaz..
Gazy rzeczywiste nie spełniają wszystkich wymienionych powyżej warunków, jednakże w warunkach niskiego ciśnienia i wysokiej temperatury, własności gazów rzeczywistych są zbliżone do modelu gazu doskonałego.
Stan gazu określają wartości trzech parametrów intensywnych: ciśnienia, temperatury oraz objętości molowej i dlatego zadaniem teorii stanu gazu jest znalezienie współzależności między tymi parametrami. Obserwacje doświadczalne nad zachowaniem się gazów rzeczywistych (Ar, He, H2) w warunkach niskiego ciśnienia i wyższej temperatury prowadzą do równania stanu, słusznego dla gazu doskonałego:
pV = nRT
lub
pVm = RT
gdzie: p - ciśnienie gazu
V - jego objętość
n - liczba moli
Vm = V/n - objętość 1 mola gazu
T - jego temperatura
R - stała gazowa
Występująca w powyższych równaniach stała gazowa R jest stałą uniwersalną, której sens fizyczny można określić na podstawie znanej zależności termodynamicznej, określającej pracę objętościową gazu W:
W = -p∆Vm = R∆T
Jeżeli rozważymy 1 mol gazu oraz przyrost temperatury ∆T = 1, to W = R. Zatem, stała gazowa równa jest pracy izobarycznego rozprężenia 1 mola gazu doskonałego, jeżeli przyrost temperatury spowodowany ogrzaniem go, wynosi jeden stopień. Stała gazowa jest wielkością wymiarową, której wartość liczbowa i jednostka zależą od wartości i jednostek parametrów użytych do jej obliczenia. W warunkach normalnych, tzn. pod ciśnieniem po = 1atm = 1,013*105 Nm-2 oraz w temperaturze To = 273,15K wszystkie gazy ( o własnościach zbliżonych do doskonałych) mają jednakową objętość molową Vo = 22,4 dm3mol-1.
Stąd dla n =1:
R = (poVo)/To = (1,013*105 Nm-2 * 22,4*10-3 m3mol-1)/(273,15K) = 8,314 J mol-1 K-1
Różnice w zachowaniu się gazów rzeczywistych i doskonałych wynikają głównie z dwóch przyczyn; w gazach rzeczywistych nie można pominąć oddziaływań międzycząsteczkowych oraz objętości własnej cząsteczek. Odstępstwa od doskonałości są tym większe, im wyższe jest ciśnienie i niższa temperatura gazu.. Znana jest duża liczba różnych empirycznych i pół empirycznych równań stanu, które w odpowiednich warunkach ciśnienia i temperatury dają wyniki mniej lub bardziej zgodne z doświadczeniem. Im jednak dokładniejsze równanie, tym więcej zawiera stałych i jest tym samym mniej dogodne w zastosowaniu.
Jak pokazuje praktyka, w zakresie średnich ciśnień i temperatur zachowanie się gazów rzeczywistych najdogodniej opisuje równanie van der Waalsa. Biorąc pod uwagę oddziaływania międzycząsteczkowe i wpływ objętości własnej cząsteczek, van der Waals zaproponował „poprawienie” równania gazu doskonałego i przedstawił je w postaci:
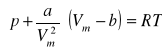
Dla n moli gazu, równanie przyjmuje następującą postać:
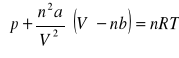
gdzie a, b - stałe charakterystyczne dla danego gazu. Sens pozostałych parametrów wyjaśniono powyżej.
Wyrażenie ![]()
oznacza tzw. korektę ciśnieniową i nosi nazwę ciśnienia wewnętrznego. Korekta ciśnieniowa uwzględnia fakt, że pomiędzy cząsteczkami gazu istnieją siły wzajemnego przyciągania tym większe, im mniejsza jest odległość między nimi. Zatem, w miarę wzrostu ciśnienia gazu siły międzycząsteczkowe odgrywają coraz większą rolę i gaz zmniejsza swoją objętość bardziej, niżby to wynikało z równania stanu gazów doskonałych. Rezultat jest więc taki, jak gdyby na gaz działało dodatkowe ciśnienie. Chcąc więc poprawnie przedstawić zachowanie się gazów rzeczywistych, należy do równania stanu doskonałego wprowadzić w miejsce p, ciśnienie sumaryczne ![]()
. Poprawka Nb wprowadzona do objętości uwzględnia fakt, że podczas sprężania gazu ulega zmianie nie cała objętość zajmowana przez gaz, a jedynie wolna przestrzeń nie zajęta przez jego cząsteczki.
Równanie stanu gazu doskonałego może służyć za podstawę teoretyczną do wyznaczania mas cząsteczkowych ciał ciekłych i stałych, łatwo przechodzących w stan pary. Dla tego typu substancji można stosować metodę V. Meyera.
Liczba moli gazu n jest związana z jego masą m i masą molową M znaną relacją:
![]()
Stąd na podstawie wzorów (1) i (6) otrzymuje się równanie wiążące cztery parametry doświadczalne: m, p, V, T, pozwalające wyznaczyć masę molową substancji badanej:
![]()
W metodzie V. Meyera bezpośrednio waży się masę substancji m, odczytuje temperaturę T i ciśnienie gazu p, a na drodze oddzielnego pomiaru- stanowiącego istotę metody - znajduje jego objętość V. Cechą charakterystyczną jest to, że nie wyznacza się bezpośrednio objętości zajmowanej przez parę badanej substancji. Taki pomiar musiałby być dokonywany w temperaturze wyższej niż jej temperatura wrzenia, czyli dość wysokiej. Zamiast tego, mierzy się objętość wypchniętego przez tę parę powietrza z aparatu V. Meyera, po ochłodzeniu go do temperatury pokojowej. Powstająca z badanej substancji para wypycha z aparatu taką samą objętość powietrza, jaką w danej temperaturze sama zajmuje. Zgodnie z prawem Avogadra, wypchnięte powietrze zawiera tyle samo moli cząsteczek npow, co pary badanej substancji:
npow = n
Na podstawie doświadczalnie wyznaczonych: objętości powietrza Vpow w temperaturze pomiaru (pokojowej) Tpow i pod ciśnieniem ppow, można obliczyć liczbę moli npow
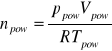
Wobec zależności (8) oraz powyższych wyjaśnień, równanie (7) pozwalające obliczyć mase molową substancji badanej M, przyjmie postać:
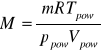
Zamiast więc objętości V jaką zajmowałaby para substancji w temperaturze T i pod ciśnieniem p wewnątrz aparatu, do obliczenia masy molowej M z równania (10), wstawia się parametry: Vpow, Tpow, ppow, dotyczące powietrza wypchniętego przez parę badanej substancji.
2.CEL ĆWICZENIA
Celem ćwiczenia jest wyznaczenie masy molowej ciekłej substancji lotnej metodą V. Meyera.
3.TABELA WYNIKÓW POMIARÓW
m [g] |
Tpow [K] |
Vpow [m3] |
b [Pa] |
ppary wodnej [Pa] |
ppow [Pa] |
M [g*mol-1] |
0,0239 |
295,15 |
5,3*10-6 |
100000 |
2700 |
97300 |
114 |
4.OPRACOWNIE WYNIKÓW
Obliczam masę molową badanej substancji
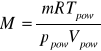
gdzie: - m [g]
- R [ J mol-1 deg-1]
- Tpow [K]
- ppow [Pa]
- Vpow [m3]
![]()
M = 114 [g/mol]
Przeprowadzam rachunek błędu wiedząc że masa cząsteczkowa substancji wynosi 119 g/mol
114*0,03=3,42
M = 114 ± 3,42 [g/mol]
5.WNIOSKI
Wartość masy molowej uzyskana podczas wykonania doświadczenia wynosi 114 g/mol i odbiega ona od wartości teoretycznej wynoszącej 119 g/mol .Może to być spowodowane szeregiem czynników wpływających na pomiar takich jak; niedoskonałość oka eksperymentatora podczas odczytu poziomu objętości powietrza [Vpow] z biurety, zmienne warunki otoczenia; ciśnienie, temperatura spowodowane np. otwarciem okna lub drzwi. Błąd może zależeć według mnie głównie od tych dwóch czynników. Jednakże musimy wziąśc także poprawkę ok. 3% wynikającą z zastosowania równania stanu gazu doskonałego do opisu gazów rzeczywistych, jak również przybliżone założenie o jednakowym współczynniku rozszerzalności objętościowej wszystkich gazów i par.
4
Wyszukiwarka
Podobne podstrony:
chemia fizyczna-ćwiczenie 13, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczn
Sprawozdanie ćwiczenia nr 14damiana, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia
Fizyczna27m, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczna i analityczna u
Sprawozdanie damiana nr 1, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczna i
poprawa II 25, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczna i analityczna
Chfizyczna5, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczna i analityczna u
moje 4, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczna i analityczna uł, Ch
wfizyczna9, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczna i analityczna uł
fizyczna 20, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczna i analityczna u
fizyczna25, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczna i analityczna uł
Wstęp teoretyczny, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczna i anality
poprawa, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczna i analityczna uł, C
fIZYCZNA5, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczna i analityczna uł,
13 fiza word, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczna i analityczna
fizyczna nr 17 moja, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczna i anali
moje 18, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczna i analityczna uł, C
więcej podobnych podstron