Oznaczanie zasadowości wód naturalnych metodą potencjometryczną
- miareczkowanie do pH ok. 8,3 OH-+H+=H2O
- miareczkowanie do pH ok. 4,5 CO32-+H+=HCO3 , HCO3-+H+=H2O+CO2
Kwasowość I zasadowość obliczamy ze wzorów:
-zasadowość mineralna Zm=( V1*CM(HCl)/Vp)*1000 [mmol/dm3]
-zasadowość ogólna Zog=( V2*CM(HCl)/Vp)*1000 [mmol/dm3]
Gdzie: V1- ilość roztw. HCl zużyta do zmiareczkow. Próbki wody badanej do pH 8,3; cm3
V2 - ilość roztw. HCl zużyta do zmiareczkow. Próbki wody badanej do pH 4,5; cm3
Vp - objętość próbki wody użytej do oznaczenia
CM(HCl) - stężenie roztw HCl; mol/dm3
Oznaczanie węgla organicznego w glebie
Utlenianie węgla przy pomocy K2Cr2O7 :
3C+2 K2Cr2O7+8H2SO4=2K2SO4+2Cr2(SO4)3+8H2O+3CO2
W celu zapewnienia ilościowego przebiegu reakcji dodawany jest siarczan(VI) srebra lub rtęci(II), który spełnia rolę katalizatora.
Dla 3 mg węgla uzyskuje się absorbancję 0,235. Ze względu na liniową zależność pomiędzy absorbancją A i zawartością węgla S w mg C, po odpowiednim przekształceniu, otrzymamy zależność:
S=(3*A)/0,235 [mg C]
W związku z tym, uwzględniając odważkę m [g] oznaczanej próbki glebowej, % zawartość C wyraża się wzorem:
W=(1,277*A)/m [%]
gdzie W- procentowa zaw. C organ. w glebie; A-absorbancja roztw; m-odważka oznaczanej próbki glebowej w g.
Oznaczanie fosforu w glebie
Nie ma żadnych reakcji ani wzorów ;)
Oznaczanie potasu w glebie
Tu też nic
Oznaczanie sodu w wodzie
Pomiar zasolenia metodą konduktometryczną
Κ=b*c
Κ (kappa)- przewodność właściwa, µS*cm-1
b- współczynnik przeliczeniowy
c-stężenie jonów, mmol/dm3
np. dla Na2SO4:
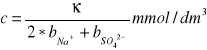
Współczynniki (25oC)
Jon |
b |
Cl- NO3- HCO3- SO42- CO32- Mg2+ Ca2+ Na+ K+ |
75,9 71,0 43,6 147,8 169,2 93,2 104 48,9 72 |
Oznaczanie azotu amonowego metodą miareczkowania alkacymetrycznego po wstępnej destylacji
Nog= NNH4+ NNO2+ NNO3+ Norg
W środowisku alkalicznym słabe zasady są wypierane ze swoich soli. Amoniak należy do słabych zasad, więc po dodaniu NaOH do H2O, w której znajdują się sole amonowe, będzie zachodziła reakcja wymiany, np.:
NH4Cl+NaOH=NaCl+NH3+H2O
Żeby całkowicie wydzielić z próbki amoniak należy część próbki oddestylować. Destylat zawierający amoniak zbiera się w odmierzonej ilości roztworu kwasu solnego o znanym stężeniu. Zachodzi reakcja:
NH3+HCl=NH4Cl
Zawartość azotu amonowego obl ze wzoru:
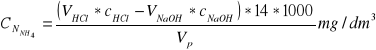
gdzie: VHCl - obj mianowanego roztw HCl wlana do odbieralnika, cm3
cHCl - stężenie mianowanego roztw HCl; mol/dm3
VNaOH - obj mianowanego roztw NaOH zużyta na miareczkowanie próbki, cm3
CNaOH - stężenie mianowanego roztwNaOH; mol/dm3
Vp - obj próbki, cm3
14-masa molowa azotu
1000-przelicznik z dm na cm
Oznaczanie utlenialności
2MnO4-+5Na2C2O4+16H+=2Mn2++10Na++10CO2+8H2O
Utlenialność wyliczamy z wyrażenia:
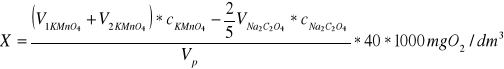
gdzie:
V1KMnO4 - obj roztw KMnO4 wprowadzona na początku do próbki, cm3
V2KMnO4 - obj roztw KMnO4 zużyta do miareczkowania, cm3
cKMnO4 - stężenie roztw KMnO4, mol/dm3
VNa2C2O4 - obj roztw Na2C2O4 wprowadzona do próbki, cm3
cNa2C2O4 - stężenie roztw Na2C2O4, mol/dm3
Vp - objętość próbki, cm3
2/5 - ilość moli KMnO4 reagująca z jednym molem Na2C2O4
40 - utlenialność odpowiadająca reakcji próbki z i milionem KMNO4
1000 - przelicznik z dm na cm
Wyszukiwarka