Podstawowe jednostki używane w chemii
Masy atomów, jąder i cząstek elementarnych:
atomowa jednostka masy równa jest 1/12 masy atomu węgla ![]()
.
masa 1 atomu ![]()
= 19,932·![]()
kg
![]()
Masa atomowa (względna masa atomowa) - liczba określająca ile razy masa atomu danego pierwiastka jest większa od 1/12 masy atomu węgla ![]()
.
![]()
przy czym za masę 1 atomu pierwiastka X przyjmuje się "średnią ważoną" naturalnych izotopów tego pierwiastka, występujących w przyrodzie:
![]()
udział wagowy izotopu ![]()
+
+ ![]()
udział wagowy izotopu ![]()
+...+
+ ![]()
udział wagowy izotopu ![]()
Wartości mas atomowych pierwiastków - układ okresowy, tablice chemiczne
np.: MH = 1,0079 u
MO = 15,999 u,
MC = 12,011 u,
MN = 14,007 u,
masy atomów - od 1 do 261 u
Masa cząsteczkowa (względna masa cząsteczkowa) - liczba określająca ile razy masa cząsteczki danego związku jest większa od 1/12 masy atomu węgla ![]()
.
Masa cząsteczkowa stanowi sumę mas atomowych pierwiastków wchodzących w skład cząsteczki związku.
Przykład 1. Obliczyć masę 1 atomu miedzi.
MCu (z tablic) = 63,546 u
mCu = 63,546 u = 63,546 1,661·![]()
kg = 105,5499·![]()
kg ≈ 105,55·![]()
kg
Przykład 2. Obliczyć masę cząsteczkową kwasu azotowego(V).
wzór cząsteczki kwasu azotowego(V) HNO3
z tablic: MH = 1,0079 u; MN = 14,007 u MO = 15,999 u
M (HNO3) = 11,0079 + 114,007 + 315,999 = 63,0119 u
Przykład 3. Obliczyć masę 1 cząsteczki kwasu azotowego(V).
M (HNO3) = 63,0119 u
m HNO3 = M (HNO3) u = 63,01191,661·![]()
kg = 104,66276·![]()
kg
Mol - miara liczności
1 mol - liczba cząstek (atomów, cząsteczek, jonów, elektronów itp) równa liczbie atomów zawartych w 12 g izotopu węgla ![]()
.
Liczba cząstek w 1 molu - liczba Avogadro (N)
N = 6,0221367![]()
± 3,6![]()
[mol-1]
(w przybliżeniu N = 6,022![]()
mol-1)
Masa molowa - masa 1 mola każdej substancji, tzn. masa liczby Avogadro cząstek (atomów, cząsteczek, jonów, elektronów itp):
masa 1 mola cząstek X = masa 1 cząstki X liczba Avogadro
np.:
- masa 1 mola atomów chloru, którego masa atomowa = 35,453 u, wynosi:
MCl = 35,453 u 1,661·![]()
kg 6,022![]()
mol-1 = = 35,44 g/mol
u N
- masa 1 mola atomowych jednostek masy wynosi:
1,661·![]()
kg 6,022![]()
mol-1 = 1,0002542 g/mol ≈ 1,0 g/mol
Masę molową substancji przyjmuje się jako liczbowo równą masie atomowej/cząsteczkowej tej substancji, wyrażoną w gramach/mol.
Przykład 4. Obliczyć masę 1 cząsteczki kwasu azotowego(V).
korzystając z obliczeń poprzednich:
masa 1 mola HNO3 = 63,0119 g/mol
zatem, masa 1 cząsteczki HNO3:
![]()
Przykład 5. Obliczyć ile moli:
a) cząsteczek wodoru
b) atomów siarki
c) atomów tlenu
zawarte jest w 0,5 mola kwasu siarkowego(VI).
Kwas siarkowy(VI) - H2SO4
w 1 molu kwasu zawartych jest: 1 mol cząsteczek wodoru,
1 mol atomów siarki
4 mole atomów tlenu,
tzn.: w 0,5 mola kwasu siarkowego zawarte jest:
0,5 1 = 0,5 mola cząsteczek wodoru
0,5 1 = 0,5 mola atomów siarki
0,5 4 = 2 mole atomów tlenu.
Przykład 6. Obliczyć ile moli:
a) atomów wapnia
b) atomów fosforu
c) cząsteczek tlenu
zawarte jest w 15,5087 g ortofosforanu(V) wapnia.
MCa = 40,078 u; MP = 30,974 u; MO = 15,999 u;
masa 1 mola ortofosforanu(V) wapnia wynosi:
M Ca3(PO4)2 = 3 40,078 g/mol + 2 30,974 g/mol + + 8 15,999 g/mol = 310,174 g/mol
15,5087 g ortofosforanu(V) wapnia stanowi zatem:
![]()
czyli w 15,5087 g ortofosforanu(V) wapnia zawarte jest:
3 0,05 = 0,15 mola atomów wapnia
2 0,05 = 0,10 mola atomów fosforu
4 0,05 = 0,20 mola cząsteczek tlenu.
Prawo Avogadro (szczegółowe)
Objętość 1 mola każdego gazu w warunkach "normalnych" wynosi 22,415 dm3.
![]()
warunki normalne:
temp. 0C ciśnienie 1013,25 hPa (1 atm)
Obecne brzmienie tego prawa:
Objętość 1 mola każdego gazu w warunkach standardowych wynosi 22,71108(19) dm3
warunki standardowe:
temp. 273,16 K ciśnienie 100 kPa (0,9869 atm)
Przykład 7. Obliczyć ile atomów chloru zawartych jest w 44,83 cm3 tego gazu zmierzonego w warunkach normalnych
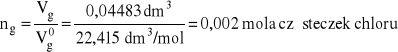
0,002 mola cząsteczek chloru zawiera 0,004 mola atomów chloru
liczba atomów chloru = 0,004 N = 0,0046,022![]()
= 0,024088![]()
= 2,4088![]()
Zadania
1. Obliczyć przybliżoną masę atomową pierwiastka stanowiącego mieszaninę trzech izotopów o liczbach masowych 28 (92,21 %), 29 (4,70 %) i 30 (3,09 %).
2. Masa atomowa talu wynosi 204,384 u. Tal zawiera 2 izotopy:
203Tl - dokładna masa atomowa - 202,972 u
205Tl - " - 204,975 u
Obliczyć udział procentowy obu izotopów.
3. Obliczyć bezwzględną masę atomu uranu.
4. Obliczyć bezwzględną masę cząsteczki:
a) siedmiowodnego siarczanu(VI) wodorotlenku żelaza(II).
b) cząsteczki tlenku diwodorotlenku manganu(IV).
c) pięciowodnego metakrzemianu magnezu.
5. Obliczyć ile cząsteczek znajduje się w:
a) 0,027 mola tlenu, ile to jest atomów,
b) 5,0 g tlenu.
6. Obliczyć ile moli lub, jaka część mola:
a) cząsteczek tlenu,
b) atomów wodoru,
c) atomów glinu
zawarta jest w 9,48 g dwunastowodnego siarczanu(VI) glinu i potasu.
7. Obliczyć ile moli lub, jaka część mola:
a) atomów tlenu,
b) cząsteczek wodoru,
c) atomów azotu
zawarta jest w 6,36 g diwodoroortoarsenianu(V) amonu.
8. Obliczyć ile moli lub, jaka część mola:
a) atomów wodoru,
b) cząsteczek tlenu,
c) atomów magnezu
zawarta jest w 7,13 g węglanu wodorotlenku magnezu.
9. Obliczyć masę cząsteczkową związku wiedząc, że cząsteczka zawiera 9 atomów C, 13 atomów H i 2,33·10-23 g innych składników. Obliczyć bezwzględną masę 1 cząsteczki tego związku.
10. Obliczyć stosunek wagowy pierwiastków w związkach: CO2, Fe2S3.
11. Obliczyć wartości współczynników stechiometrycznych w związkach, napisać wzory sumaryczne tych związków:
a) P2Ox (M = 110 u)
b) H4P2Ox (M = 178 u)
12. Która z próbek zawiera więcej cząsteczek:
a) 1 g H2O czy 1 g NH3,
b) 3 g O2 czy 3 g H2.
13. Która z próbek zawiera większą liczbę cząsteczek:
a) 1 mol tlenu czy 1 mol ozonu
b) 1 dm3 tlenu czy 1 dm3 ozonu zmierzone w warunkach normalnych,
c) 1,0 g tlenu czy 1,0 g ozonu.
14. Która z próbek zawiera więcej cząsteczek:
a) 1,0 g wody czy 1,0 g amoniaku
b) 10 g kwasu siarkowego(VI) czy 10 g kwasu ortofosforowego(V)
15. Obliczyć liczbę atomów rtęci zawartą w 2 cm3 rtęci. (dHg = 13,6 g/cm3, MHg = 200,59 u)
16. Jedna kropla wody morskiej zawiera około 50 miliardów (109) atomów złota. Obliczyć masę złota, którą można by uzyskać z 1 tony wody morskiej, jeżeli masa 1 kropli wody wynosi około 50 mg.
17. Cząsteczka pewnego związku ma masę równą 2·10-22 g. Obliczyć masę tej cząsteczki w jednostkach masy atomowej. Obliczyć masę 1 mola tego związku.
18. Izotop kobaltu 60Co można wykryć w ilości 10-11 g. Oszacować ile to jest atomów.
19. Obliczyć masę węgla zawartą w 220 g ditlenku węgla.
20. Obliczyć masę 1 m3 tlenu w warunkach normalnych.
21. Obliczyć liczbę moli azotu zawartą w 62,7 dm3 tego gazu odmierzonego w warunkach normalnych.
22. Mieszanina gazowa ma skład: 25 % wodoru, 25 % tlenu, 25 % azotu i 25 % chloru. Obliczyć masę próbki tej mieszaniny, zawierającej łącznie 2,4·1023 cząsteczek.
23. Złoto jest metalem, który można rozwalcować do folii o grubości około 70 nm. Obliczyć:
a) powierzchnię folii złota wykonaną z 1 g tego metalu, jeżeli gęstość złota wynosi 19,3 g/cm3,
b) masę 10 cm2-takiej folii.
24. Zakładając, że ziarenko drobnego piasku ma średnicę około 0,2 mm, obliczyć:
a) objętość jaką zajmie mol ziaren piasku,
b) liczbę ziaren piasku zawartą w 1 dm3 piasku.
25. Obliczyć masę 20 dm3 tlenu zmierzonego w warunkach normalnych.
26. Butla zawiera 5,0 kg ciekłego chloru. Obliczyć objętość, jaką zajmie ta ilość chloru w warunkach normalnych.
27. Trzy próbki, każda o masie 5,0 g: azotu, tlenku węgla i ditlenku węgla wprowadzono do trzech naczyń utrzymując w nich jednakowe warunki ciśnienia i temperatury. Uszeregować te próbki wg malejącej objętości przez nie zajmowanej.
28. Obliczyć gęstość w warunkach normalnych: tlenu, wodoru, siarkowodoru.
29. Obliczyć objętość, jaką w warunkach normalnych zajmie 12,04·1024 cząsteczek chlorowodoru.
30. Obliczyć masę cząsteczkową gazu, jeżeli jego gęstość w warunkach normalnych wynosi 1,96 g/dm3.
Odpowiedzi
1. 28,1088 u
2. zaw. 203Tl = 29,506 %, zaw. 205Tl = 70,494 %
3. m 1 atomu uranu = 395,4·10-24 g
4. a) 610,74·10-24 g; b) 174,30·10-24 g c) 316,24·10-24 g
5. a) 1,6·1022; 3,2·1022 b) 9,41·1022
6. a) 0,2 mola cząsteczek tlenu, b) 0,48 mola atomów wodoru
c) 0,02 mola atomów glinu
7. a) 0,16 mola atomów tlenu b) 0,12 mola cząsteczek wodoru
c) 0,04 mola atomów azotu
8. a) 0,1 mola atomów wodoru b) 0,125 mola cząsteczek tlenu
c) 0,1 mola atomów magnezu
9. Mzw. = 135,24 u; masa 1 cząsteczki = 224,63·10-24 g
10. mC : mO = 3 : 8 mFe : mS = 7 : 6
11. a) P2O3 b) H4P2O7
12. a) więcej cząsteczek zawiera 1 g NH3
b) 3 g H2 zawierają więcej cząsteczek niż 3 g O2
13. a) obie próbki zawierają jednakowe liczby cząsteczek
b) obie próbki zawierają jednakowe liczby cząsteczek
c) 1 g tlenu zawiera więcej cząsteczek niż 1 g ozonu
14. a) więcej cząsteczek zawiera 1 g amoniaku
b) obie próbki zawierają jednakowe liczby cząsteczek
15. 8,2·1022
16. 3,27·10-2 mg
17. Mx = 120,5 u masa 1 mola = 120,5 g
18. w ilości 10-11 g 60Co zawarte jest ~1011 atomów
19. 60 g
20. 1428,6 g
21. 2,8
22. 13,3 g
23. a) 700 m2
b) 1,43·10-6 g
24. a) 25·1011 m3
b) 2,4·108
25. 28,57 g
26. 1577,5 dm3
27. Vazotu > Vtlenu > Vditlenku węgla
28 dtlenu = 1,428 g/dm3; dwodoru = 0,089 g/dm3; dsiarkowodoru = 1,518 g/dm3
29. 448 dm3
30. 43,904 u
5
Wyszukiwarka