Ćwiczenie nr 34a.
Temat: Wyznaczanie równoważnika elektrochemicznego wodoru i tlenu przy pomocy aparatu Hoffmana.
LITERATURA:
Podręczniki uniwersyteckie z fizyki ogólnej.
H. Szydłowski „Pracownia fizyczna”.
T. Dryński „Ćwiczenia laboratoryjne z fizyki”.
W. F. Nozdriew „Ćwiczenia laboratoryjne z fizyki ogólnej”.
ZAGADNIENIA KOLOKWIALNE:
Dysocjacja elektrolityczna. Elektroliza. Prawa elektrolizy.
Własności dielektryczne ciał.
Wyznaczenie równoważnika elektrochemicznego wodoru i tlenu przy pomocy aparatu Hoffmana - zasada pomiaru.
ZAGADNIENIA EKSPERYMENTALNE:
Wyznaczyć równoważnik elektrochemiczny wodoru i tlenu.
PRZEBIEG DOSWIADCZENIA:
Mierzymy gęstość elektrolitu przy pomocy aerometru.
Ostrożnie wlewamy elektrolit do woltametru.
Łączymy układ pomiarowy według schematu.
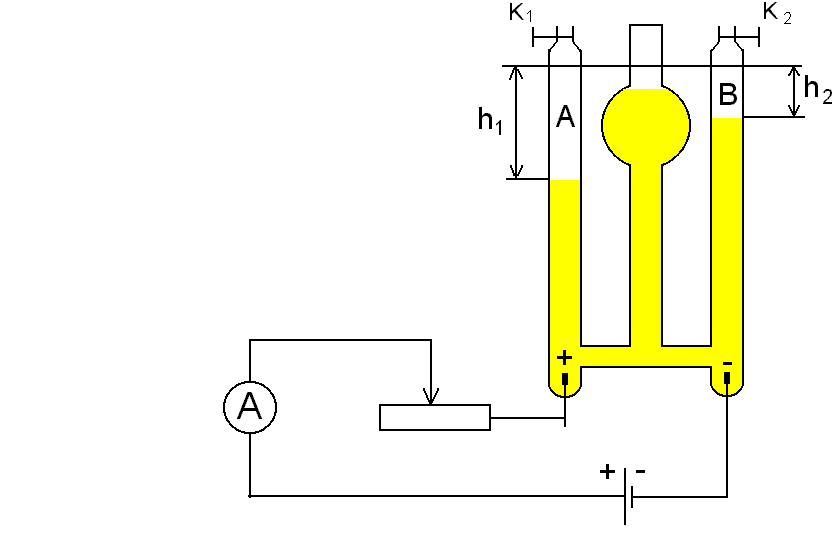
Włączamy prąd i przy pomocy opornicy suwakowej ustalamy jego natężenie w granicach 0,4-0,5 A tak, aby pęcherzyki gazów wydzielały się szybko, ale nie gwałtownie. Wyłączamy prąd i otwierając zawory K1 i K2 usuwamy gaz wydzielony w czasie próby.
Zamykamy zawory K1 K2 . Włączamy prąd uruchamiając jednocześnie stoper. Notujemy natężenie prądu w czasie elektrolizy „I”. Gdy gaz wydzielający się na katodzie wypełni 2/3-3/4 części rurki prąd wyłączamy. Notujemy czas przebiegu elektrolizy „t” i objętość gazów wydzielonych w rurkach „A” i „B”.
Przy pomocy katetometru mierzymy różnice poziomów słupów elektrolitu h1 i h2. Mierzymy temperaturę elektrolitu, uznając, że jest to temperatura wydzielonego gazu. Odczytujemy stan ciśnienia atmosferyczngo (barometr rtęciowy, pokój nr 14).
Obliczamy masy wydzielonych gazów korzystając ze wzoru:
![]()
gdzie: ρ0 jest gęstością, a V0 objętością gazu w warunkach normalnych.
Gęstość gazu ρ0 odczytujemy z tablic fizycznych. Natomiast V0 obliczamy z równania Clapeyrona wykorzystując dane eksperymentalne i mając na uwadze to, że w rurce woltametru znajduje się mieszanina wydzielonego gazu i pary wodnej nasyconej w danej temperaturze. Ciśnienie pary wodnej nasyconej w danej temperaturze można odczytać z tablic .
Mając dane masy wydzielonych gazów, „I” i „t” obliczamy równoważniki elektrochemiczne wodoru i tlenu. Oceniamy błąd pomiaru. Uzyskane wyniki porównujemy z danymi tablicowymi.
Uwaga: Należy zachować dużą ostrożność przy posługiwaniu się roztworem kwasu siarkowego. Wlewanie i wylewanie roztworu przeprowadzać w obecności asystenta technicznego, lub asystenta prowadzącego zajęcia.
Konieczne mycie rąk (zlew obok). W celu ochrony garderoby należy ubrać fartuch ochronny.
Aparatura:
Aparat Hoffmana + dwie elektrody, zasilacz prądu stałego, opornica suwakowa 50 Ω, katetometr, amperomierz 0,75-3 A, roztwór wodny H2SO4 (elektrolit), barometr (sala 14).
Wyszukiwarka