Badanie równowagi fazowej w układzie trójskładnikowym
CH3COOH - H2O - badana ciecz
Aby w pełni opisać stan układu znajdującego się w równowadze musimy wprowadzić pojęcie potencjału chemicznego. Jest to wielkość intensywna i ma określoną wartość w każdym miejscu fazy i nie zależy od całkowitej masy, ale jedynie od jej stanu wewnętrznego. Z definicji potencjał chemiczny jest molową parcjalną energią swobodną i - tego składnika:
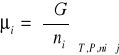
Przy stałej temperaturze i ciśnieniu dla każdego ze składników układu w stanie równowagi potencjał chemiczny musi być taki sam we wszystkich fazach, czyli muszą być spełnione równania:
![]()
gdzie: α - liczba składników niezależnych
β - liczba faz
Wiedząc, że liczba tych równań wynosi α(β-1) oraz, że stan termodynamiczny opisuje 2+β(α-1) parametrów intensywnych, możemy wyprowadzić równanie opierające się na różnicy między całkowitą liczbą parametrów opisujących stan układu a liczbą związków między nimi:
![]()
gdzie: s - liczba stopni swobody.
Powyższe równanie nosi nazwę reguły faz Gibbsa.
W układzie trójskładnikowym, jakim będziemy zajmować się w doświadczeniu βmax = 5. Właściwości takich układów bada się przy stałym ciśnieniu i temperaturze co ogranicza liczbę stopni swobody do wartości s =α - β, a w zależności od wzajemnej rozpuszczalności składników istnieją jedno- i dwufazowe układy trójskładnikowe.
Stan takich układów najłatwiej jest przedstawić trójkątnym układem współrzędnych zaproponowanym przez Gibbsa. Jest to trójkąt równoboczny, którego wierzchołki odpowiadają 100% zawartości składnika A, B i C w mieszaninie, punkty leżące na bokach - układy dwuskładnikowe, a punkty leżące wewnątrz trójkąta - układy trójskładnikowe.
Celem naszego zadania jest wyznaczenie właśnie takiego trójkąta dla układu woda - kwas octowy - chloroform i zaznaczenie na nim granicy istnienia faz w zależności od składu roztworu.
Pomiary i obliczenia
W celu wyznaczenia trójkąta stężeń Gibbsa przygotowujemy 10 butelek o różnej zawartości wody i kwasu octowego i miareczkujemy chloroformem, aż do uzyskania zmętnienia (2 fazy).
Nr butelki |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
woda [cm3] |
10 |
9 |
8 |
7 |
6 |
5 |
4 |
3 |
2 |
1 |
kwas octowy [cm3] |
- |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
chloroform [cm3] |
0,15 |
0,17 |
0,20 |
0,24 |
|
|
|
|
|
|
Za pomocą programu komputerowego obliczamy % wagowy poszczególnych składników w roztworze:
Nr butelki |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
woda [% wag.] |
97,8 |
87,34 |
76,92 |
66,60 |
55,63 |
43,10 |
25,36 |
16,88 |
7,33 |
2,02 |
kwas octowy [% wag.] |
0,00 |
10,19 |
20,19 |
29,97 |
38,94 |
45,26 |
39,94 |
41,35 |
30,80 |
19,05 |
chloroform [% wag.] |
2,20 |
2,47 |
2,88 |
3,43 |
5,43 |
11,64 |
34,71 |
41,77 |
61,87 |
78,93 |
Na podstawie powyższych obliczeń wykreślamy trójkąt stężeń Gibbsa:
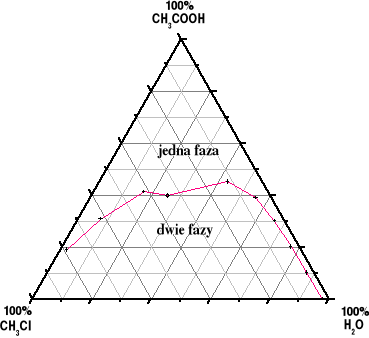
Z powyższego diagramu możemy wywnioskować, że pomiary zostały wykonane dokładnie, poza pomiarem butelki nr 7, co widać na wykresie. Błędem mogło być nie uchwycenie pierwszego trwałego zmętnienia i przemiareczkowanie roztworu.
Wykreślając diagram fazowy możemy wyznaczyć zatem linię graniczną (czerwona linia na wykresie łącząca otrzymane w doświadczeniu punkty) występowania jednej i dwóch faz w roztworze w zależności od składu procentowego składników.
- 2 -
Wyszukiwarka