Wyznaczenie stałej szybkości procesu jodowania acetonu katalizowanego jonami H+ jest celem tego ćwiczenia. Sumaryczne równanie reakcji zachodzącej podczas tego procesu obrazuje zapis:
CH3-CO-CH3 + I2 -> CH3-CO-CH2I + H+ + I- (1)
Proces chlorowcowania ketonu jest dwu etapowy. Dzieje się tak, ponieważ reakcje między ketonami i chlorowcami (Cl2,Br2,J2) w środowisku wodnym są pierwszego rzędy względem ketonu i rzędu drugiego względem chlorowca. Prawdą jest także fakt, iż szybkości procesu jodowania, chlorowania i bromowania są identyczne.
Pierwszym etapem omawianego procesu jodowania jest enolizacja ketonu, która decyduje szybkości reakcji sumarycznej reakcji.
CH3 - C - CH3 CH2 = C - CH3 (2)
O OH
Aceton występuje zwykle w dwóch postaciach: ketonowej i enolowej. W temperaturze pokojowej ta druga forma stanowi zaledwie 2,5x10-3%. Kwasy i zasady katalizują proces enolizacji acetonu. Schemat mających wtedy miejsce przemian przedstawiają poniższe reakcje:
CH3 - C - CH3 + H+ ![]()
CH3 - C - CH3 (3)
O +OH
CH3 - C - CH3 ![]()
CH2 = C - CH3 + H+ (4)
+OH OH
Utworzony jon reaguje z jodem J3:
CH3 - C - CH3 + I3 ![]()
ICH2-C-CH3 + 2I- + H+ (5)
OH O
Jon I3 otrzymujemy przez rozpuszczenie I2 w roztworze KI. Stałą równowagi reakcji I2 + I- =I3 w temperaturze 25oC wynosi K≅800, co tłumaczy dominacje w roztworze reagenta I3.
Szybkość reakcji jodowania acetonu zależy od stężenia formy enolowej, ale nie zależy od stężenia jodu, ponieważ szybkość przegrupowania formy ketonowej w enolową również nie zależy od ilości tego chlorowca. Proces (2) jest katalizowany przez jony H+, których stężenia zmienia się w czasie tej reakcji, ponieważ są jednym z jej produktów.
W rezultacie zgodnie z sumarycznym równaniem reakcji (1) zmniejszeniu stężenia acetonu o x moli odpowiada identyczne zwiększenie stężenia jonów H+. Wynika z tego, że szybkość reakcji jodowania acetonu wyraża w tym przypadku zależność:
![]()
(6)
![]()
(7)
a, b - początkowe stężenia acetonu i jonów wodorowych
x - stężenie produktu
Postęp reakcji śledzimy oznaczając stężenie I2 za pomocą miareczkowania roztworem tiosiarczanu sodu:
I2 + 2Na2S2O3 -> Na2S4O6 + 2NaI (8)
Dodanie skrobi pozwala na łatwiejsze zaobserwowanie końca miareczkowania, ponieważ tworzy ona z wolnym jodem niebiesko zabarwiony kompleks.
Wyniki pomiarów dokonanych podczas przeprowadzania doświadczenia zawiera tabela nr.1
Tabelanr.1
t |
Vt |
[min] |
[ml] |
0 |
18,6 |
15 |
17,95 |
32 |
17,3 |
46 |
16,8 |
62 |
16,4 |
76 |
15,9 |
91 |
15,35 |
Znając objętości poszczególnych składników wykorzystanych do sporządzenia badanego roztworu można obliczyć jego parametry początkowe, takie jak stężenia acetonu a i kwasu w próbce. W tym celu posługujemy się wzorem:
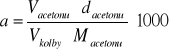
(9)
![]()
(10)
Vacetonu = 3ml - objętość acetonu
Vkolby= 250ml - objętość kolby
dacetonu = 0,7905g/cm3 - gęstość acetonu
Macetonu = 58g/mol - masa molowa acetonu
Obliczając przyrost stężenia kwasu możemy określić w jakim stopniu przebiegła enolizacja. Ze stechiometrii reakcji redukcji jodu tiosiarczanem sodu (równanie 8) wynika, że ubytek stężenia I2jest dwukrotnie mniejszy od różnicy ilości moli Na2S2O3 zużytych na początku (Vo) i po czasie t (Vt) trwania reakcji na miareczkowanie nadmiaru jodu. Wiemy, że ubytek stężenia jodu jest równy przyrostowi stężenia acetonu x i możemy go obliczyć ze wzoru:
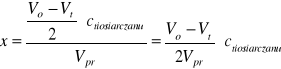
(11)
x - ubytek stężenia acetonu = przyrost stężenia jonów H+
Vo,Vt - ilośći Na2S2O3 na miareczkowanie mieszaniny
Vpr = 25ml - objętość próbki
ctiosiarczanu= 0,02M
Wielkości obrazujące przebieg reakcji jodowania acetonu zawarte są w tabeli nr.2
Tabela nr.2: Stężenia reagentów podczas procesu jodowania acetonu
t |
Vt |
x |
a-x |
b+x |
|
[min] |
[ml] |
|
|
|
|
0 |
18,6 |
0 |
0,1635 |
0,08 |
-0,7148 |
15 |
17,95 |
2,6x10-4 |
0,16324 |
0,08026 |
-0,7099 |
32 |
17,3 |
5,2 x10-4 |
0,16298 |
0,08052 |
-0,7051 |
46 |
16,8 |
7,2 x10-4 |
0,16278 |
0,08072 |
-0,7014 |
62 |
16,4 |
8,8 x10-4 |
0,16262 |
0,08088 |
-0,6984 |
76 |
15,9 |
1,08 x10-3 |
0,16242 |
0,08108 |
-0,6947 |
91 |
15,35 |
1,3 x10-3 |
0,1622 |
0,0813 |
-0,6907 |
Wyniki z tabeli nr.2 posłużyły do sporządzenia wykresu obrazującego zależność ![]()
=f(t) (wykres nr.1).
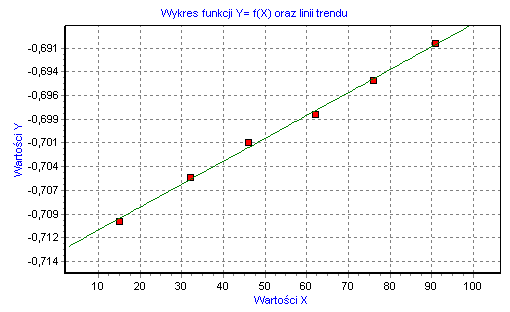
Wykres nr 1.
Nachylenie prostej ![]()
+k(a+b)t obliczone metodą najmniejszych kwadratów wynosi 2,4718x10-4. Z tego wynika, że współczynnik kierunkowy prostej jest iloczynem sumy stężeń acetonu i jonów H+ oraz stałej szybkości reakcji. Stąd wzór na stałą k przyjmuje postać:
![]()
![]()
(12)
Wpływ na błędne obliczenia stałej szybkości reakcji jodowania acetonu miał błąd paralaksy przy odczytaniu ilości zużytego tiosiarczanu podczas miareczkowania oraz ilości substancji przy przygotowywaniu roztworu. Zakłócenia wynikające z pobierania próbki z badanego roztworu (lekkie oziębienie kolby a co się z tym wiąże zmniejszenie szybkości reakcji) mogło negatywnie odbić się na wyniku doświadczenia. Zanieczyszczenia na ściankach kolby oraz zlewek mogły nieznacznie zmienić skład roztworu i zniekształcić wynik oznaczeń.
Wyszukiwarka