Analityczna - przykładowe pytania
I zestaw
Co to jest mol?
Prawo działania mas - teoria wyprowadzenie wzorów.
Zadanie: Z 38% roztworu HCl o d=1,19g/cm3 otrzymać 2 litry roztworu o stężeniu 0,05M.
Czym według teorii protonowej w roztworze wodnym są: HCO3-,
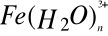
. Napisz równania i oblicz ph ).1 molowego roztworu. pk0= 2,3Prawo Ostwalda - wyprowadzenie wzoru.
Oblicz ph buforu (50ml 0,2 molowego amoniaku i 40ml 0,25mol chlorku amonu). Jakie będzie ph jeśli do roztworu dodamy:
a) 10ml 0,2mol HCl
b) 10ml 0,2mol KOH
1litr roztworu zawiera pewną ilość KOH zanieczyszczoną węglanem sodu. Na miareczkowanie 25ml tego roztworu wobec fenolu zużyto 27,2ml HCl o stężeniu 0,1032mol/l zaś wobec oranżu metylowego 1,8ml tego kwasu. Oblicz procentową zawartość węglanu sodu w NaOH. Napisz reakcje zachodzące wobec wskaźników.
Potencjał normalny.
Redoksy:
a) Cu + HCl
b) Fe + HCl
c) Cu + HNO3
d) Cu2+ + Fe
Oznaczanie fenolu.
Kompleksy proste i chelatowe.
Do amoniakalnego roztworu zawierającego jony Ni2+ wprowadzono alkoholowy roztwór dimetyloglikoksymu. Napisz jaki powstanie kompleks.
Warunkowe stałe trwałości.
Jakie kompleksy tworzy EDTA z metalami?
Czynniki wpływające na rozpuszczalność osadu.
Metoda Volharda.
Na czym polega i jakie ma zalety strącanie z układów homologicznych?
II zestaw
Co to jest mol?
Co to jest jednostka masy atomowej? (Nie wystarczy sama nazwa)
Prawo zachowania mas.
Prawo działania masy. Wyprowadzić wzór na stałą równowagi.
Co to jest dysocjacja elektrolityczna?
Co to jest stała dysocjacji?
Co to jest stopień dysocjacji?
Wyprowadzić wzór dotyczący zależności stałej dysocjacji.
Kwasy i zasady wg teorii Bronsteda.
Czy anion może być kwasem? Odpowiedź uzasadnij.
Moc kwasów i zasad.
Co to są bufory? Dlaczego po dodaniu kwasu i zasady nie zmienia się ph?
Oznaczanie NaOH i NaCO3 metodą Werdera. (reakcje, dochodzenie wyniku)
Jak przygotować 2dm3 0,2M roztworu HCl z 36% roztworu HCl o d = 1,18g/cm3.
Oblicz stężenie molowe roztworu o Cp = 50% i d = 1,4g/cm3.
Oznaczanie fenolu metodą bromianometryczną.
Napisz reakcje utleniania i redukcji kwasu szczawiowego z nadmanganianem potasu.
Napisz reduktory z pytania 16 i 17.
Uzupełnij współczynniki jeśli zachodzą reakcje:
a) Zn + HNO3
b) Cu + HCl
c) Zn + HCl
d) Cu + HNO3
e) Fe + H2SO4
Co to jest liczba koordynacyjna?
Co to jest EDTA? Jak reaguje z metalami?
Jak określamy trwałość kompleksu?
Jak działają wskaźniki w kompleksometrii?
Jak oznacza się kompleksometrycznie wapń i magnez w próbce zawierającej oba jony?
Efekt wspólnego jonu: jak następuje zwiększenie i zmniejszenie rozpuszczalności?
Efekt solny: jak następuje zwiększenie i zmniejszenie rozpuszczalności?
Napisz reakcjami metodę Volharda. Kiedy się ją stosuje?
Wyszukiwarka