Opracowanie wyników pomiarów Michał Michalak
1. Obliczam masę m poszczególnych składników w roztworach po miareczkowaniu. Biorę pod uwagę objętości V oraz gęstości cieczy d [g cm-3]:
Temperatura T [K] |
Woda |
Toluen |
Etanol |
293 |
0,99823 |
0,86696 |
0,78932 |
308 |
0,99406 |
0,85301 |
0,77639 |
Korzystam ze wzoru: ![]()
Obliczenia podaję dla wody w objętościach: woda - 0,5 cm3, toluen - 5,5 cm3 i etanol - 4,3 cm3. Pozostałe wyniki obliczeń umieściłem w tabeli poniżej.
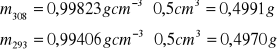
2. Skład mieszanin wyrażam w procentach wagowych c [% wag].

3. Wykreślam izotermę rozpuszczalności w temperaturze 293 K i 308 K przedstawiając wyniki obliczeń w trójkącie Gibbsa-Roosebooma.
Tabela wyników obliczeń:
Skład badanych mieszanin w temperaturze T2 = 308 K |
|||||||||
Woda |
Toluen |
Etanol |
|||||||
Vw [cm3] |
m [g] |
c [%wag] |
Vt [cm3] |
m [g] |
c [%wag] |
V0 [cm3] |
VO + V1 [cm3] |
m [g] |
c [%wag] |
0,5 |
0,497 |
5,829 |
5,5 |
4,692 |
55,020 |
2 |
4,3 |
3,338 |
39,152 |
1,0 |
0,994 |
10,023 |
5,0 |
4,265 |
43,006 |
3 |
6,0 |
4,658 |
46,971 |
2,0 |
1,988 |
17,122 |
4,0 |
3,412 |
29,386 |
4 |
8,0 |
6,211 |
53,492 |
3,0 |
2,982 |
23,656 |
3,0 |
2,559 |
20,300 |
4 |
9,1 |
7,065 |
56,044 |
4,0 |
3,976 |
29,572 |
2,0 |
1,706 |
12,688 |
4 |
10,0 |
7,764 |
57,741 |
5,0 |
4,970 |
37,657 |
1,0 |
0,853 |
6,463 |
4 |
9,5 |
7,376 |
55,881 |
|
|
|
|
|
|
|
|
|
|
Skład badanych mieszanin w temperaturze T1 = 293 K |
|
||||||||
Woda |
Toluen |
Etanol |
|
||||||
Vw [cm3] |
m [g] |
c [%wag] |
Vt [cm3] |
m [g] |
c [%wag] |
VO + V1 + V2 [cm3] |
m [g] |
c [%wag] |
|
0,5 |
0,499 |
5,511 |
5,5 |
4,768 |
52,653 |
4,8 |
3,789 |
41,836 |
|
1,0 |
0,998 |
9,398 |
5,0 |
4,335 |
40,812 |
6,7 |
5,288 |
49,790 |
|
2,0 |
1,996 |
15,985 |
4,0 |
3,468 |
27,767 |
8,9 |
7,025 |
56,248 |
|
3,0 |
2,995 |
21,945 |
3,0 |
2,601 |
19,059 |
10,2 |
8,051 |
58,997 |
|
4,0 |
3,993 |
27,711 |
2,0 |
1,734 |
12,033 |
11,0 |
8,683 |
60,256 |
|
5,0 |
4,991 |
35,481 |
1,0 |
0,867 |
6,163 |
10,4 |
8,209 |
58,356 |
|
Celem ćwiczenia było wyznaczenie izotermy rozpuszczalności w układzie trójskładnikowym: woda-toluen-etanol w dwóch temperaturach T1 = 293 K i T2 = 308 K.
Do sprawozdania dołączyłem wykres wykonany na papierze milimetrowym.
Po wykonaniu przeze mnie trójkąta Gibbsa-Roosebooma stwierdzam, że połączone punkty dla odpowiednich temperatur wyznaczają izotermę rozpuszczalności, czyli krzywą równowagi między układem jednofazowym i dwufazowym. Obszar leżący poniżej izotermy odpowiada układowi dwufazowemu, zaś nad krzywą układowi jednofazowemu. Położenie izotermy rozpuszczalności w trójkącie zależy od temperatury. W temperaturze wyższej (T2>T1) maleje pole układu dwufazowego ze względu na lepsze warunki mieszania roztworów.
Przykładem trójskładnikowego układu o ograniczonej rozpuszczalności jest mieszanina stosowana w doświadczeniu. W układzie tym toluen i woda nie mieszają się ze sobą, tworząc dwie fazy ciekłe. Dodanie alkoholu etylowego powoduje wzrost wzajemnej rozpuszczalności obu faz i prowadzi do całkowitej homogenizacji układu.
1
Wyszukiwarka