Sprawozdanie
ĆWICZENIE NR 20
TEMAT:WYZNACZANIE STAŁEJ SZYBKOŚCI INWERSJI CUKRU
Aparatura:
Polarymetr POLAMAT A
Wyposażenie:
naczynko wagowe
3 kolby poj. 100 cm2
3 zlewki poj. 100 cm2
2 pipety poj. 10 cm2
1 pipety poj. 50 cm2
lejek, bagietka, łopatka
Odczynniki:
3n roztwór HCI
sacharoza
Wstęp:
Kinetyka zajmuje się zmiennością w czasie układów chemicznych. Badania kinetyczne dostarczają informacji o przebiegu reakcji chemicznych oraz stanowią podstawę technologicznego projektowania reaktorów.
Wyniki pomiarów kinetycznych opisujemy równaniami , które w większości przypadków wyrażają zależność reakcji r od stężeń reagentów i od temperatury .
Według Boudarta celem podstawowych badań kinetycznych jest:
ustalenie schematu reakcji,
zaproponowanie sekwencji aktów elementarnych,
wyjaśnienie przebiegu aktu elementarnego.
Szybkość reakcji chemicznej r w układzie reakcyjnym o stałej objętości definiujemy jako zmianę stężenia c reagenta w czasie t:
![]()
Jest ona wielkością intensywną. W przypadku, gdy c odnosi się do substratów w równaniu dopisujemy znak minus.
Centralnym problemem kinetyki chemicznej jest znalezienie równania kinetycznego
![]()
gdzie T jest temperaturą bezwzględną, a ci - stężeniem reagenta i.
Szybkość nieodwracalnej reakcji chemicznej r po rozdzieleniu zmiennych, wyraża równanie:
![]()
Gdzie współczynnik k, zwany stałą szybkości reakcji, jest niezależny od stężeń reagentów, zależy natomiast od temperatury.
Funkcja f (ci) ma postać:
![]()
gdzie iloczyn rozciąga się na wszystkie składniki układu λi jest rzędem reakcji względem składnika i. Rząd reakcji zawarty jest zwykle w granicach -2 < λi < 2. W szczególnym przypadku może on być równy zero. Szybkość reakcji nie zależy wówczas od składnika i.
Sumę wykładników potęgowych λi , zwaną całkowitym rzędem reakcji, oznaczamy symbolem n.
Równanie kinetyczne jest zależnością czysto empiryczną, którą można się bezpiecznie posługiwać tylko w warunkach, dla których została ona wyznaczona.
Stała szybkości reakcji zależy wykładniczo od temperatury (równanie Arrheniusa) :
![]()
Gdzie R jest stałą gazową, E energię aktywacji, a A - czynnikiem przedwykładniczym.
Logarytmując równanie Arrheniusa otrzymujemy:
![]()
W celu wyznaczenia stałych E i A bada się szybkość reakcji w różnych temperaturach, a znalezione stałe szybkości reakcji k na wykresie w układzie współrzędnych: ln k - odwrotność temperatury bezwzględnej 1/T. W przeważającej liczbie przypadków wykres ln k od 1/T jest linią prostą, z której równania możemy wyznaczyć wartość E i A. Dla większości reakcji chemicznych energie aktywacji wahają się w granicach kilkudziesięciu do kilkuset kilodżuli na mol.
Reakcja inwersji sacharozy, prowadzona bez obecności kwasu, jest reakcją dwucząsteczkową o równaniu:
C12H22O11 + H2O = C6H12O6 + C6 H12O6
sacharoza glikoza fruktoza
Jeżeli przeprowadzi się ją w rozcieńczonym roztworze wodnym, to względne zużycie wody jest tak niewielkie, że praktycznie można uznać stężenie wody za stałe. Zamiast równania kinetycznego
![]()
Po włączeniu stałego c H2O = const do stałej i podstawieniu k' c H2O = k0' szybkość tej reakcji wyraża równanie
![]()
Szybkość inwersji praktycznie zmienia się proporcjonalnie do stężenia sacharozy. Otrzymane równanie jest pierwszego rzędu. Reakcje takie noszą nazwę pseudojednocząsteczkowych .
![]()
po rozdzieleniu zmiennych
![]()
a po scałkowaniu
![]()
dla momentu początkowego t = 0, c = co, stała const = ln co
stąd ![]()
wiedząc ,że aktualne stężenie substratu (sacharozy) jest c otrzymujemy
ln![]()
Wszystkie trzy cukry są optycznie czynne. Sacharoza skręca płaszczyznę światła spolaryzowanego silnie w prawo, glikoza - słabo w prawo, a fruktoza bardzo silnie w lewo. W czasie biegu reakcji następuje, z uwagi na wzrost stężenia fruktozy, zmiana kata skręcania.
Kąt skręcania α substancji optycznie czynnej w danej temperaturze i dla danej długości światła zależy od długości d drogi światła i od stężenia c danej substancji
α = β dc
gdzie β - skręcalność właściwa.
Oznaczając przez αo wartość kąta skręcania w momencie początkowym (po czasie t1), przez α wdanym czasu ti, a przez α∞ - po zakończeniu reakcji (t = ∞) , można również przedstawić w postaci
![]()
Różnica kątów skręcania (α o - α ∞ ) jest bowiem proporcjonalna do początkowego stężenia co substratu, a (α o - α ∞ ) do stężenia aktualnego c.
Równanie to można przekształcić do postaci
ln (α o - α ∞) - ln (α - α ∞) = kot
lub - ln (α - α ∞) = - ln (α o - α ∞) + kot
co daje równanie prostej o współczynniku kierunkowym ko i rzędnej przecięcia z osią równej - ln (α о - α ∞).
Przebieg ćwiczenia
Sporządzenie 20% roztworu cukru poprzez rozpuszczenie 12,5g cukru w 50cm3 wody . Następnie 15cm3 roztworu przelałem do kolby miarowej o poj. 50cm3 i uzupełniłem do kreski roztworem kwasu solnego . Zanotowałem czas dodania kwasu - t0 . Dokładnie wymieszałem roztwór a następnie przelałem do rurki polarymetrycznej i rozpocząłem pomiar kąta skręcania .Przez pierwsze 30 min. odczytów dokonywałem co 5 minut , przez kolejne 30 minut co 10 minut.
Następnie podniosłem temperaturę układu do 40º C i utrzymywałem ją przez 50 minut . Potem ponownie obniżyłem temperaturę do 20ºC utrzymywałem ją przez 15 minut . Po tym czasie ponownie odczytałem kąt skręcenia roztworu . Jest to wartość odpowiadająca skręcalności po czasie t∞ .
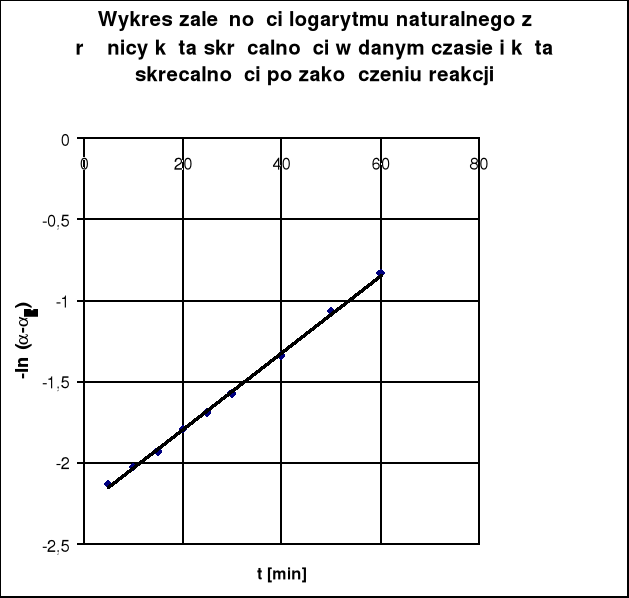
Obliczenia
Nr Pomiaru |
Czas [min] |
Kąt skręc. [o] α |
(α-α∞) |
y= -ln (α-α∞) |
t2 |
yt
|
1 |
t1=5 |
7,1 |
8,4 |
-2,12823 |
25 |
-10,6412 |
2 |
t2=10 |
6,3 |
7,6 |
-2,02815 |
100 |
-20,2815 |
3 |
t3=15 |
5,6 |
6,9 |
-1,93152 |
225 |
-28,9728 |
4 |
t4=20 |
4,7 |
6 |
-1,79176 |
400 |
-35,8352 |
5 |
t5=25 |
4,1 |
5,4 |
-1,6864 |
625 |
-42,16 |
6 |
t6=30 |
3,5 |
4,8 |
-1,56862 |
900 |
-47,0585 |
7 |
t7=40 |
2,5 |
3,8 |
-1,335 |
1600 |
-53,4 |
8 |
t8=50 |
1,6 |
2,9 |
-1,06471 |
2500 |
-53,2355 |
9 |
t9=60 |
1 |
2,3 |
-0,83291 |
3600 |
-49,9745 |
10 |
t10= ∞ |
-1,3 |
0 |
∞ |
∞ |
∞ |
|
∑t = 255 |
|
|
∑y = -14,3673 |
∑t2 = 9975 |
∑yt = -341,559 |
|
(∑t)2 = 65025 |
|
|
n = 9 |
|
|
Wyznaczamy stałą szybkości reakcji k metodą najmniejszych kwadratów:
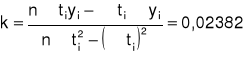
Określamy jaka była skręcalność roztworu α0 w momencie zmieszania roztworu wiedząc, że odcięta punktu przecięcia prostej -ln (α-α∞)= f (t) z osią rzędnych ma wartość daną równaniem:
![]()
α0= e -a + α∞
α0= e2,27127- 1,3
α0= 8,392
Określamy czas, po którym przereaguje połowa substratów wiedząc, że:
![]()
3
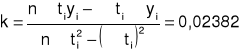
![]()
![]()
Wyszukiwarka