Wyznaczanie ΔG, ΔH oraz ΔS reakcji chemicznej
Pomiar odwracalnej wartości siły elektromotorycznej orz znajomość reakcji sumarycznej umożliwiają bezpośrednie i dokładne obliczenie potencjału termodynamicznego reakcji. Jeżeli w reakcji bierze udział liczba elektronów n razy większa od liczby Avogadra przepływowi nF kulombów ładunku odpowiada zmiana potencjału termodynamicznego określona wzorem:
∆G = - nFE
Powyższe równanie daje się prosto wyprowadzić rozważając ogniwo chemiczne w którym przebiega reakcja sumaryczna: aA + bB ⇔ cC + dD.
Potencjał termodynamiczny 1 mola substancji A można określić wzorem:
![]()
natomiast potencjał termodynamiczny a moli tej substancji wzorem:
![]()
Wyprowadzając powyższe równania dla wszystkich reagentów A, B, C i D, można wyznaczyć potencjał termodynamiczny sumarycznej reakcji ogniwa, który wyniesie odpowiednio:
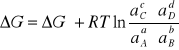
gdzie: ∆G° oznacza różnicę między potencjałami termodynamicznymi produktów i substratów, gdy wszystkie reagenty znajdują się w swoich stanach standardowych.
Zgodnie z równaniem Nernsta siła elektromotoryczna omawianego ogniwa będzie równa:
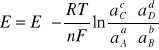
Z porównania obydwu wzorów otrzymujemy prosty wzór na zmianę potencjału termodynamicznego: ![]()
i ![]()
. Czyli określając zależność SEM od temperatury można wyznaczyć entropię i ciepło reakcji.
Znając termodynamiczną zależność entropii z potencjałem termodynamicznym, czyli:
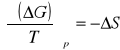
i podstawiając wcześniej wyprowadzone równanie otrzymujemy wzór postaci:
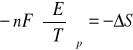
, czyli 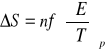
który umożliwia obliczenie entropii reakcji na podstawie współczynnika temperaturowego siły elektromotorycznej ogniwa. Korzystając zaś z kolejnej zależności postaci: ![]()
możemy obliczyć entalpię reakcji w danej temperaturze. Zatem pomiar SEM i jej współczynnika temperaturowego umożliwiają określenie ∆G, ∆H i ∆S dla przebiegającej w ogniwie reakcji. Drogą pomiarów SEM uzyskuje się więc wiele informacji termodynamicznych o wodnych roztworach jonowych.
W doświadczeniu jakie będziemy przeprowadzać zmierzymy wartość E w kilku temperaturach w ogniwie Clarka i na podstawie tych danych wyznaczymy G, H i S reakcji, jaka w nim zachodzi.
Pomiary i obliczenia
W doświadczeniu wykorzystaliśmy ogniwo Clarka o schemacie:
(-) Zn (Hg), ZnSO4∙7H2O (roztwór nasycony) | Hg2SO4 (s), Hg (+)
którego źródłem siły elektromotorycznej jest reakcja:
Zn + Hg2SO4 + 7H2O = ZnSO4∙7H2O + 2Hg
Pomiaru SEM w ogniwie Clarka dokonaliśmy w zakresie temperatur od 0°C do 40°C (co dziesięć stopni) przy pomocy woltomierza. W każdej temperaturze ogniwo termostatowało się przez około 10-15 minut (wskazania przez woltomierz były stabilne).
Uzyskaliśmy następujące wyniki, według których sporządzono wykres SEM = f(t)
temperatura [°C] |
0 |
10 |
20 |
30 |
40 |
SEM [mV] |
1395 |
1378 |
1362 |
1351 |
1340 |
Na podstawie powyższych danych program komputerowy dokonał obliczeń G, H i S:
temp. [°C] |
G [J/mol] |
H [J/mol] |
S [J/mol∙K] |
0 |
-2,692∙105 |
-3,414∙105 |
-2,644∙102 |
10 |
-2,659∙105 |
-3,407∙105 |
-2,644∙102 |
20 |
-2,628∙105 |
-3,403∙105 |
-2,644∙102 |
30 |
-2,607∙105 |
-3,408∙105 |
-2,644∙102 |
40 |
-2,586∙105 |
-3,413∙105 |
-2,644∙102 |
Wnioski:
Na podstawie wyników pomiarów oraz sporządzonego wykresu wynika, że zmiana SEM ogniwa w badanym zakresie temperatur jest liniowa oraz, że ze wzrostem temperatury siła elektromotoryczna ogniwa maleje. Zależność jest obarczona niewielkim błędem (nie wszystkie punkty leżą dokładnie na wspólnej prostej), który w naszym doświadczeniu wyniósł 0,0023. Informuje on jednak, że doświadczenie zostało wykonane dokładnie.
Potencjał termodynamiczny jest funkcją, której wartość oblicza się, aby uzyskać informacje o tym, czy dana reakcja może zachodzić w określonych warunkach. Ze znaczą wydajnością mogą zachodzić tylko takie procesy, w których następuje zmniejszenie potencjału termodynamicznego, tzn. takie, w których ΔG<0. W każdej z badanych temperatur zmiana potencjału termodynamicznego dla reakcji biegnącej w ogniwie Clarka jest wartością ujemną. Oznacza to, że powyższa reakcja jest procesem samorzutnym i możliwym do zrealizowania w tych warunkach.
Zmiana entalpii w badanym zakresie temperatur również ma wartość ujemną ΔH<0 co oznacza, że reakcja jest egzotermiczna, czyli z wydzieleniem ciepła do otoczenia.
Jak można zauważyć wartość S jest taka sama niezależnie od temperatury. Zmiana entropii układu, w którym zachodzi reakcja chemiczna, nie świadczy jednoznacznie o kierunku przebiegu przemiany samorzutnej. W każdej przemianie obowiązuje warunek wzrostu entropii, ale dotyczy on całkowitej zmiany entropii układu wraz z otoczeniem. Trudno jest zmierzyć jednak entropię otoczenia. Ponieważ jednak wiemy z zasady termodynamiki, że całkowita entropia musi rosnąć, zatem pewne jest, że w trakcie przebiegu reakcji wzrosła entropia otoczenia.
Czynnik entropowy przybiera wartości mniejsze od zera, ale jest większy od ΔH. Gdyby TΔS był większy od zera, to potencjał termodynamiczny byłby równy bądź większy od zera. W pierwszym przypadku układ znajdowałby się w stanie równowagi, zaś w drugim proces przebiegałby samorzutnie w kierunku przeciwnym.
- 2 -
Wyszukiwarka