|
UNIWERSYTET ZIELONOGÓRSKI Wydział Inżynierii Lądowej i Środowiska Instytut Inżynierii Środowiska |
|
|
CHEMIA FIZYCZNA LABORATORIUM
|
|
III ROK INŻYNIERII ŚRODOWISKA STUDIA DZIENNE
|
|
|
Wyznaczenie stałej dysocjacji kwasu octowego metodą spektrofotometryczną.
TEMAT 1
|
||
Wyznaczenie stałej dysocjacji kwasu octowego...
1. METODYKA.
Dla wyznaczenia stałej dysocjacji słabego kwasu HA należy zmierzyć stopień dysocjacji α kwasu o stężeniu c. W metodzie spektrofotometrycznej opartej na prawie Lamberta-Beera wielkością mierzalną jest ekstynkcja roztworu E :
![]()
= ![]()
= ![]()
gdzie :
I0 - natężenie wiązki pierwotnej światła,
I - natężenie wiązki światła po przejściu przez roztwór barwny o grubości
L ( cm ) i stężeniu c ( mol/dm3 ),
ε - ekstynkcja molowa.
Roztwory kwasów są najczęściej bezbarwne, dodaje się do nich tzw. indykatory, których barwa zależy od stężenia jonów wodorowych.
Indykator w wodzie ulega dysocjacji zgodnie z równaniem :
![]()
= ![]()
Stała dysocjacji indykatora wyrażona jest wzorem :
![]()
lub
![]()
Zmieniając zatem pH powodujemy zmiany w stosunku stężeń [ In- ] / [ HIn ], co wywołuje zmianę widma absorpcyjnego, ponieważ postać zdysocjowana In- posiada inną barwę niż postać niezdysocjowana.
Wyznaczenie stałej dysocjacji kwasu octowego...
Spadkowi pH towarzyszy wzrost stężenia HIn. Jeżeli pomiar będzie się prowadzić przy długości fali odpowiadającej maksimum absorpcji HJn, to absorpcja roztworu powinna być ściśle zależna od stężenia jonów H+. Sprawdzenie stosowalności prawa Lamberta-Beera prowadzi się mierząc ekstynkcję indykatora jako funkcję stężenia kwasu solnego, gdyż αHCl = 1 oraz [ H+ ] = cHCl.
Otrzymana krzywa cechowania E = f [ H+] umożliwia znalezienie na podstawie zmierzonej ekstynkcji roztworu badanego słabego kwasu o stężeniu cHA - stężenia jonów wodorowych [ H+ ]. Stopień dysocjacji wyniesie :
![]()
; ![]()
; 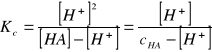
;
2. MATERIAŁY.
Aparatura : spektrofotometr, kolba miarowa ( 100ml ), butelki ze szlifem ( 250ml ) - 3szt., probówki ( 15ml ) - 14 szt., pipety ( 10ml ).
Odczynniki : kwas solny ( 0,005 molowy ), oranż metylowy ( roztwór wodny ), kwas octowy ( 0,01 molowy ).
3. WYKONANIE ĆWICZENIA.
Posługując się kolbą miarową sporządzić w kolbkach miarowych trzy roztwory (dopełniając wyjściowe roztwory do 100 ml wodą destylowaną):
A - 4,5 ml oranżu metylowego na 100 ml roztworu,
B - 20 ml roztworu HCl + 4,5 ml oranżu metylowego na 100 ml roztworu,
C - 10 ml kwasu octowego + 4,5 ml oranżu metylowego na 100 ml
roztworu.
Roztwór A odpowiada postaci indykatora In- zaś roztwór B odpowiada postaci niezdysocjowanej HIn. W czystych i suchych probówkach przygotować 10 roztworów o różnych stężeniach jonów H+, powstałych przez zmieszanie roztworów A i B w różnych stosunkach (tab.1).
Wyznaczenie stałej dysocjacji kwasu octowego...
dla : HCl [ H+ ] = cH+ = cHCl
Zmierzyć ekstynkcję roztworów i wykreślić zależności E = f [ H+ ].
Następnie w czterech probówkach sporządzić roztwory powstałe z zmierzania roztworów A i C w takich stosunkach (tab.2) aby mierzone ekstynkcje znalazły się w zakresie ekstynkcji dla kwasu solnego. Na podstawie tych ekstynkcji i krzywej cechowania dla kwasu solnego znaleźć stężenie jonów H+ w badanych roztworach i stopień dysocjacji.
dla kwasu octowego : [ H+ ] ≠ cHA; cH+ ≠ cHA
4. PRZEDSTAWIENIE WYNIKÓW POMIARÓW.
Wyniki pomiarów przedstawić w tabelach i na wykresach.
Tab.1. - Ekstynkcja roztworów (A+B) dla różnych stężeń HCl, λ = 530nm.
Lp. |
VA [ ml ] |
VB [ ml ] |
CHCl = [ H+ ]×104 |
E |
1. |
0 |
10 |
|
|
2. |
1 |
9 |
|
|
3. |
2 |
8 |
|
|
4. |
3 |
7 |
|
|
5. |
4 |
6 |
|
|
6. |
5 |
5 |
|
|
7. |
6 |
4 |
|
|
8. |
8 |
2 |
|
|
9. |
9 |
1 |
|
|
10. |
10 |
0 |
|
|
Wyznaczenie stałej dysocjacji kwasu octowego...
Rys.1. - Zależność ekstynkcji od stężenia jonów wodorowych E = f ( cH+)
Tab.2. - Ekstynkcja roztworów (A+C) dla różnych stężeń kwasu octowego, λ = 531 nm.
Lp. |
VA [ ml ] |
Vc [ ml ] |
cHA [ mol/dm3 ] |
E |
[H+] × 104 |
Kc × 105 |
1. |
3 |
7 |
|
|
|
|
2. |
2 |
8 |
|
|
|
|
3. |
1 |
9 |
|
|
|
|
4. |
0 |
10 |
|
|
|
|
5. ZAKRES MATERIAŁU.
Zakres materiału teoretycznego : równowaga chemiczna, elektrolity, dysocjacja elektrolityczna, prawo rozcieńczeń Ostwalda, prawo Lamberta-Beera, spektrofotometria.
5
E
CH+
Wyszukiwarka
Podobne podstrony:
chem.fiz.równowagi fazowe, Inżynieria środowiska, inż, Semestr III, Chemia fizyczna, laboratorium
chem.fiz.współ.podziału Nernsta, Inżynieria środowiska, inż, Semestr III, Chemia fizyczna, laborator
Wzór sprawozdania chemfiz lab, Inżynieria środowiska, inż, Semestr III, Chemia fizyczna, laboratoriu
L3chf15d, Inżynieria środowiska, inż, Semestr III, Chemia fizyczna, laboratorium
stała dyso sprawko, Inżynieria środowiska, inż, Semestr III, Chemia fizyczna
Kientyka sprawko, Inżynieria środowiska, inż, Semestr III, Chemia fizyczna
CHEMIA, Inżynieria środowiska, inż, Semestr III, Chemia fizyczna
Ćw - II Zjawiska powierzchniowe, Inżynieria środowiska, inż, Semestr III, Chemia fizyczna
instrukcja - HYDROLIZA SOLI, Inżynieria środowiska, inż, Semestr II, Chemia ogólna, laboratorium
pHmetr-instrukcja obsługi, Inżynieria środowiska, inż, Semestr II, Chemia ogólna, laboratorium
instrukcja - CHEMIA ORGANICZNA II, Inżynieria środowiska, inż, Semestr II, Chemia ogólna, laboratori
Program L1chog30d, Inżynieria środowiska, inż, Semestr II, Chemia ogólna, laboratorium
Podział kationów Lipiec Szmal, Inżynieria środowiska, inż, Semestr II, Chemia ogólna, laboratorium
instrukcja - TYPY REAKCJI CHEMICZNYCH, Inżynieria środowiska, inż, Semestr II, Chemia ogólna, labora
instrukcja - REAKCJE UTLENIANIA I REDUKCJI, Inżynieria środowiska, inż, Semestr II, Chemia ogólna, l
instrukcja - ROZTWORY BUFOROWE, Inżynieria środowiska, inż, Semestr II, Chemia ogólna, laboratorium
instrukcja - ELEKTROLITY, Inżynieria środowiska, inż, Semestr II, Chemia ogólna, laboratorium
instrukcja - ANALIZA ILOŚCIOWA-OBJĘTOŚCIOWA (miareczkowa), Inżynieria środowiska, inż, Semestr II, C
instrukcja - CHEMIA ORGANICZNA I, Inżynieria środowiska, inż, Semestr II, Chemia ogólna, laboratoriu
więcej podobnych podstron
