Imię i nazwisko Data
Ćwiczenie 7
Miareczkowanie potencjometryczne
Cel ćwiczenia
Celem ćwiczenia jest zapoznanie się z budową i obsługą pH-metru kompensacyjnego, oznaczenie zawartości HC1 i CH3COOH metodą potencjometryczną.
1. Miareczkowanie mocnego kwasu (HCl) mocną zasadą (NaOH)
Przygotowaną analizę miareczkowano dodając z biurety po 1 cm3 NaOH 0,5 mol/dm3.Miareczkowanie prowadzono do wyraźnego wzrostu pH i zmiany SEM .Miareczkowanie zakończono dodając 2 x 1 cm3 NaOH po wyraźnej zmianie.
Wyniki miareczkowania zamieszczono w tabeli :
Ilość dodanego NaOH (cm3) |
pH |
SEM |
ΔE |
ΔV |
ΔE / ΔV |
0 |
|
|
|
|
|
1 |
|
|
|
|
|
2 |
|
|
|
|
|
3 |
|
|
|
|
|
4 |
|
|
|
|
|
5 |
|
|
|
|
|
6 |
|
|
|
|
|
7 |
|
|
|
|
|
8 |
|
|
|
|
|
9 |
|
|
|
|
|
10 |
|
|
|
|
|
11 |
|
|
|
|
|
12 |
|
|
|
|
|
13 |
|
|
|
|
|
Objętość roztworu (NaOH ), która wywołała skok na krzywej miareczkowania
wynosi ………….cm3.
Do identycznie przygotowanej próby wprowadzono z biurety …………cm3 NaOH 0,5 mol/dm3. Dalej analizę miareczkowano dodając po 0,1 cm3 titranta.
Ilość dodanego NaOH (cm3) |
pH |
SEM |
ΔE |
ΔV |
ΔE / ΔV |
…. |
|
|
|
|
|
…,1 |
|
|
|
|
|
…,2 |
|
|
|
|
|
…,3 |
|
|
|
|
|
…,4 |
|
|
|
|
|
…,5 |
|
|
|
|
|
…,6 |
|
|
|
|
|
…,7 |
|
|
|
|
|
…,8 |
|
|
|
|
|
…,9 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Wykorzystując dane zamieszczone w tabelach wyznaczono punkt końcowy miareczkowania (PK)
A. metodą graficzną
- wykreślono zależność E = f ( V )
WYKRES (dołączony do protokołu )
Z wykresu odczytano objętość titranta w PK miareczkowania
PK = ….. cm3
- wykreślono zależność ΔE / ΔV = f (V)
WYKRES (dołączony do protokołu )
Z wykresu odczytano objętość titranta w PK miareczkowania
PK = ….. cm3
B. metodą algebraiczną - Hahna
Największy przyrost potencjału wynosi:
ΔEmax = ……..mV
ΔE1 = ……..mV
ΔE2 = ……..mV
Obliczono poprawkę q
q = ![]()
=
a = ΔV · q = 0,1 · q =
VPK = VΔE1 ± a
Zawartość kwasu solnego (g) w analizie wynosi :
X = 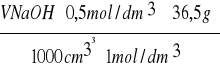
· W =
2. Miareczkowanie słabego kwasu (CH3COOH) mocną zasadą (NaOH)
Przygotowaną analizę miareczkowano dodając z biurety po 1 cm3 NaOH 0,5 mol/dm3.Miareczkowanie prowadzono do wyraźnego wzrostu pH i zmiany SEM .Miareczkowanie zakończono dodając 2 x 1 cm3 NaOH po wyraźnej zmianie.
Wyniki miareczkowania zamieszczono w tabeli :
Ilość dodanego NaOH (cm3) |
pH |
SEM |
ΔE |
ΔV |
ΔE / ΔV |
0 |
|
|
|
|
|
1 |
|
|
|
|
|
2 |
|
|
|
|
|
3 |
|
|
|
|
|
4 |
|
|
|
|
|
5 |
|
|
|
|
|
6 |
|
|
|
|
|
7 |
|
|
|
|
|
8 |
|
|
|
|
|
9 |
|
|
|
|
|
10 |
|
|
|
|
|
11 |
|
|
|
|
|
12 |
|
|
|
|
|
13 |
|
|
|
|
|
Objętość roztworu (NaOH ), która wywołała skok na krzywej miareczkowania
wynosi ………….cm3.
Do identycznie przygotowanej próby wprowadzono z biurety …………cm3 NaOH 0,5 mol/dm3. Dalej analizę miareczkowano dodając po 0,1 cm3 titranta.
Ilość dodanego NaOH (cm3) |
pH |
SEM |
|
ΔV |
ΔE / ΔV |
…. |
|
|
|
|
|
…,1 |
|
|
|
|
|
…,2 |
|
|
|
|
|
…,3 |
|
|
|
|
|
…,4 |
|
|
|
|
|
…,5 |
|
|
|
|
|
…,6 |
|
|
|
|
|
…,7 |
|
|
|
|
|
…,8 |
|
|
|
|
|
…,9 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Wykorzystując dane zamieszczone w tabelach wyznaczono punkt końcowy miareczkowania (PK)
A. metodą graficzną
- wykreślono zależność E = f ( V )
WYKRES (dołączony do protokołu )
wykresu odczytano objętość titranta w PK miareczkowania
PK = ….. cm3
- wykreślono zależność ΔE / ΔV = f (V)
WYKRES (dołączony do protokołu )
Z wykresu odczytano objętość titranta w PK miareczkowania
PK = ….. cm3
B. metodą algebraiczną - Hahna
Największy przyrost potencjału wynosi:
ΔEmax = ……..mV
ΔE1 = ……..mV
ΔE2 = ……..mV
Obliczono poprawkę q
q = =![]()
=
a = ΔV · q = 0,1 · q =
VPK = VΔE1 ± a
Zawartość kwasu octowego (g) w analizie wynosi :
X = 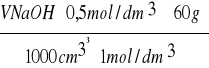
· W =
3. Pomiar pH metodą potencjometryczną
Pomierzone wartości pH przygotowanego buforu octanowego lub amonowego zamieszczono w tabeli
Bufor octanowy o pH 3,5 - 5,6
( CH3COOH 0,2 mol/dm3 , CH3COONa 0,2 mol/dm3 )
Probówka |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
cm3 |
|||||||
CH3COOH |
9,4 |
8,2 |
5,6 |
3,0 |
2,0 |
1,2 |
1,0 |
CH3COONa |
0,6 |
1,8 |
4,4 |
7,0 |
8,0 |
8,8 |
9,0 |
pH obliczone |
3,5 |
4,0 |
4,5 |
5,0 |
5,2 |
5,5 |
5,6 |
pH zmierzone |
|
|
|
|
|
|
|
Bufor amonowy o pH 8,3 - 10,2
( NH3· H2O 0,1 mol/dm3 , NH4Cl 0,1 mol/dm3 )
Probówka |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
cm3 |
|||||||
NH3· H2O |
1,0 |
2,0 |
4,0 |
5,0 |
7,0 |
8,0 |
9,0 |
NH4Cl |
9,0 |
8,0 |
6,0 |
5,0 |
3,0 |
2,0 |
1,0 |
pH obliczone |
8,29 |
8,64 |
9,06 |
9,24 |
9,61 |
9,84 |
10,2 |
pH zmierzone |
|
|
|
|
|
|
|
Wnioski:
Data wykonania ćwiczenia :
Data zaliczenia :
Ocena :
1
Wyszukiwarka