1.Opis teoretyczny :
Teorii kinetyczno-molekularnej zawdzięczamy specjalne, "mikroskopowe" ujęcie zjawisk zachodzących w otaczającym nas świecie . Teoria ta opiera się na następujących założeniach ogólnych :
ciała mają budowę nieciągłą , składają się z drobnych elementów w postaci atomów lub cząsteczek (molekuł)
cząsteczki gazu znajdują się w szybkim nieustannym , chaotycznym ruchu, poruszają się we wszystkich możliwych kierunkach, przy czym żaden z tych kierunków nie jest wyróżniony
pomiędzy poszczególnymi cząsteczkami występują siły wzajemnego oddziaływania
cząsteczki doznają zderzeń sprężystych między sobą i ścianami naczynia w których się znajdują ,
czas trwania zderzenia jest znacznie krótszy od czasu , który upływa między zderzeniami .
między zderzeniami cząsteczki poruszają się po liniach prostych
Oddziaływania międzycząsteczkowe w dużym stopniu zależą od wzajemnych
odległości między cząsteczkami i gwałtownie maleją ze wzrostem tych odległości,
dlatego dzięki stosunkowo dużym średnim odległościom międzycząsteczkowym
można w pierwszym przybliżeniu zaniedbać siły wzajemnego oddziaływania
cząsteczek .Dzięki temu można założyć, że każda cząsteczka gazu porusza się
swobodnie ( bez działania sił ) aż do momentu zderzenia z inną cząsteczką lub ze
ścianką naczynia .Stąd wniosek , że odcinki dróg między kolejnymi zderzeniami są
przebywane ruchem jednostajnym prostoliniowym . Wobec zupełnej przypadkowości
zderzeń drogi te mają różne długości
Cząsteczki podczas zderzeń zmieniają swe prędkości. Zderzenia cząsteczek
gazowych można traktować jako zderzenia doskonale sprężyste , a średnia długość
prostoliniowego przebiegu między dwoma zderzeniami , wyliczona z bardzo wielkiej
liczby tych przelotów, nosi nazwę średniej drogi swobodnej . Jej wartość dla tlenu w
warunkach normalnych wynosi 6,4·10-8 m . Wyznaczono też średnie prędkości ruchu
cząsteczek . Dla tlenu w temperaturze 0C wynosi 425 m/s.
Wyróżniamy następujące przemiany gazowe :
1. Przemiana izotermiczna - zachodzi w stałej temperaturze ( T = const )Do przemiany
tej odnosi się prawo Boyle'a - Mariotte'a.
p1· V1/T = p2 · V2 /T / T
p1· V1 = p2· V2
czyli
p· V = const.
W przemianie izotermicznej ciśnienie jest odwrotnie proporcjonalne do objętości.
W stałej temperaturze średnia energia kinetyczna cząsteczek jest niezmienna . Jeśli
masa jest określona , to liczba cząsteczek N zawartych w tej masie jest stała
p· V = 2/3N· m2/2
Jeśli zrobimy wykres izotermy p = f(V) , otrzymamy gałąź hiperboli równobocznej.
Przy przemianie izotermicznej gaz rozszerzając się wykonuje pracę .
Ponieważ energia wewnętrzna gazu przy tej przemianie jest stała , z pierwszego prawa termodynamiki wynika , że gaz może wykonywać izotermiczne pracę tylko kosztem dostarczonego z zewnątrz ciepła . Praca wykonana przez gaz przy rozprężaniu jest równa
W = pV
Stosując rachunek całkowy , pracę tę możemy wyrazić dokładniej wzorem :
W = pdV
Z równania gazów doskonałych
p = RT/V
gdzie R - stała gazowa
a zatem
W =RTdV/V = RT ( ln V2- lnV1)
stąd ostatecznie
W = RT ln(V2/V1)
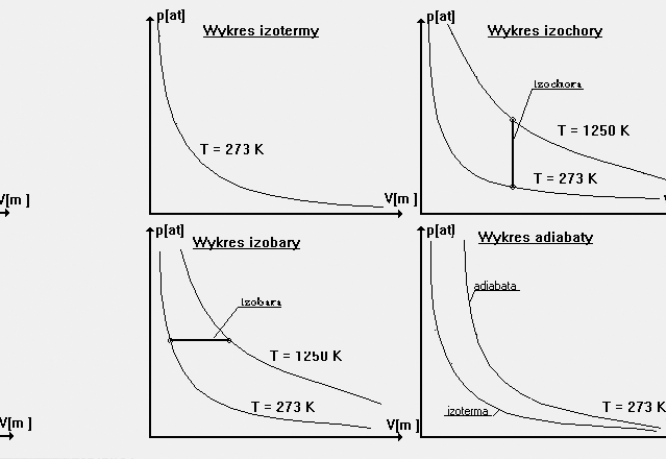
2. Przemiana izochoryczna- zachodzi przy stałej objętości (V = const ).Realizujemy
ją gdy w zamkniętym pomieszczeniu znajduje się gaz który oziębiamy lub ogrzewamy.
Z równania stanu gazu doskonałego wynika że dla przemiany izochorycznej
p/T = const
czyli ciśnienie jest wprost proporcjonalne do temperatury bezwzględnej gazu .
Wykresem p = f(V) tej przemiany jest odcinek równoległy do osi rzędnych .Przy
przemianie tej gaz nie wykonuje pracy na zewnątrz , natomiast rośnie jego energia
wewnętrzna w związku ze zmianą temperatury.
3. Przemiana izobaryczna - zachodzi przy stałym ciśnieniu (p = const).
Z równania gazów doskonałych wynika , że pod stałym ciśnieniem
V/T = const
czyli objętość jest wprost proporcjonalna do temperatury w K. Na wykresie p = f( V )
izobarę przedstawia odcinek równoległy do osi odciętych . Przy przemianie
izobarycznej gaz rozprężając się wykona pracę
W = p(V2 - V1)
gdyż V2 - V1 oznacza przyrost objętości.
4. Przemiana adiabatyczna - zachodzi bez wymiany ciepła z otoczeniem .
Q = 0 , Q = const
Ponieważ dla jednego mola gazu doskonałego
U = CVT
mamy dla przemiany adiabatycznej na podstawie pierwszej zasady termodynamiki
CVT = -pV
gdzie CV - ciepło molowe przy stałej objętości .
Na podstawie równania Clapeyrona , ciśnienie p wyrażone jest wzorem
p = RT/V ,
a zatem mamy:
CVT+RT/VV = 0
dzieląc przez T znajdziemy stąd
CVT/T+R V/ v = 0
Przechodząc do różniczek możemy związek ten napisać w postaci
CVdT/T+R dV/ v = 0
zaś ostatni związek możemy od razu scałkować korzystając z tego , że dT/T jest
pochodną lnT , zaś dV/V pochodną lnV . A zatem po scałkowaniu mamy
CVlnT+RlnV = const
R = Cp-CV
gdzie Cp -ciepło molowe przy stałym ciśnieniu.
Ten związek przybierze postać
TCvV Cp-CV = const
ciągniemy jeszcze z obu stron pierwiastki stopnia CV ,znajdziemy wtedy
TV(Cp-CV)/Cv= const
wprowadzimy oznaczenie
= Cp/CV
związek TV(Cp-CV)/Cv= const możemy napisać w postaci
TV-1 =const
z równania gazu doskonałego
T = pV/R
ostatecznie otrzymujemy równanie adiabaty w postaci :
p· V = const
Wykres p = f(V) adiabaty przebiega bardziej stromo niż izotermy .
Oprócz wymienionego wyżej prawa Boyle'a - Mariotte'a przemiany gazowe opisują
jeszcze prawa : Avogadra i Daltona . Prawo Avogadra mówi , że w jednakowych
objętościach różnych gazów mierzonych pod tym samym ciśnieniem i w tej samej
temperaturze znajduje się jednakowa liczba cząsteczek
N1 = N2
Prawo Daltona mówi zaś , że ciśnienie jest równe sumie ciśnień cząstkowych p1,
p2,p3, .... jakie wywierają poszczególne gazy wchodzące w skład mieszaniny zajmując
każdy z osobna całą objętość V :
p = p1+p2+p3+.....
Ciepło właściwe dowolnego ciała wyraża się liczbowo jako ilość ciepła potrzebna do
ogrzania 1 kg ciała o 1 deg ( 1C lub 1K ) . Jednostką ciepła właściwego , jest:
J/(KG· deg)
Ciepło właściwe jest nie tylko funkcją temperatury , zależy ono także od tego czy
ogrzewanie ciała odbywa się z zachowaniem stałej objętości , czy też pod stałym
ciśnieniem . Podczas ogrzewania ciała z zachowaniem stałej objętości ciepło musi być
dostarczone jedynie na wykonanie przyrostu energii wewn. związanego ze wzrostem
temperatury , natomiast podczas ogrzewania pod stałym ciśnieniem ciało rozszerza się
i pokonuje opór wynikający z istnienia zewnętrznego ciśnienia , a zatem wykonuje
pracę . W tym przypadku ciepło zużywane jesz na zwiększenie energii wewnętrznej
ciała oraz na wykonanie pracy związanej ze zmianą objętości . Ciepło właściwe pod
stałym ciśnieniem Cp jest większe od ciepła właściwego stałej objętości Cv .Często
posługujemy się ciepłem molowym zdefiniowanym jako ilość ciepła , które należy
dostarczyć 1 molowi ciała , aby podnieść jego temperaturę o 1C. Między ciepłem
molowym C , a ciepłem właściwym istnieje związek C = C gdzie - masa drobinowa
danego ciała .
Przy ogrzewaniu pod stałym ciśnieniem
Cp - Cv = R R - stała gazowa
Cp = Cv+R = {(i+2)/2}· R i - ilość stopni swobody
Biorąc pod uwagę oba równania mamy :
= Cp/Cv = (i+2)/2 - dla danego gazu jest wielkością stałą
Przez liczbę stopni swobody drobin rozumiemy liczbę niezależnych współrzędnych
koniecznych do opisania jej ruchu . Drobiny gazu mogą wykonywać tylko ruchy
postępowe ( gaz jednoatomowy ) . Opisanie tego ruchu wymaga 3 współrzednych .
Drobiny gazu dwu i wieloatomowych mogą wykonywać także ruchy rotacyjne oraz
oscylacyjne . W przypadku gazów dwuatomowych i = 5 ( 3 współrzędne ruchu
postępowego + 2 rotacyjne - dookoła dwóch wzajemnie prostopadłych osi ).
Uwzględnienie możliwości oscylacji zwiększa liczbę stopni swobody do 7 ( 2
dodatkowe współrzędne do opisania energii kinetycznej drgań oraz wzajemnej energii
potencjalnej atomów ) . W myśl prawa ekwipartycji energii na każdy stopień swobody
przypada średnio ta sama ilość energii . Energia wew. gazu doskonałego jest suma
energii kinetycznej ruchu cieplnego wszystkich cząsteczek gazu , znajdujących się
w danej objętości:
U = N· f kT/ 2 = f RT/2 N- liczba Avogadro
f- liczba stanów swobody
Jeśli 1kmol ogrzewamy w stałej objętości przy czym przyrost temp = dT , to
doprowadzone ciepło dQ = CvdT , ponieważ gaz nie zmienia objętości , czyli nie
wykona pracy dW = 0 więc dQ = dU = CvdT
U = f R/2 T = Cv T Cv = fR/2
Przypuśćmy , że w zbiorniku mamy 1 kmol gazu . Ciepło dQ potrzebne do ogrzania o dT:
dQ = Cp
dQ+ dW = dU lub CpdT- pdV= CvdT
pV = RT - różniczkując dla procesu izobarycznego p = const
pdV = RdT podstawiając CpdT- RdT = CvdT /:dT
Cp-Cv = R
Zgodnie z poprzednim
Cv = fR/2 = dU/dT więc
Cp = Cv+R = fR/2 + R = R (f+2)/2 a = Cp/Cv = (f+2)/f
Metoda doświadczalna znajdowania .
W dużym naczyniu szklanym N o objętości kilkudziesięciu litrów zawarty jest
badany gaz , znajdujący się pod ciśnieniem p niewiele wyższym od ciśnienia
atmosferycznego . Gaz zamknięty jest kurkiem , który w pewnej chwili otwieramy i
zamykamy ponownie z chwilą wyrównania się ciśnienia z ciśnieniem atmosferycznym .
Powietrze rozpręża się , przy czym można przyjąć , że rozprężenie to zachodzi
adiabatycznie , ulega ono przy tym oziębieniu .
Po pewnym czasie dzięki wymianie z otoczeniem temperatura powietrza pozostałego
w naczyniu zrówna się w temp. otoczenia i wskutek ogrzania ciśnienie gazu podniesie
się , wytworzy się więc nadwyżka ciśnienia , tym razem mniejsza od nadwyżki
początkowej.
Niech początkowa nadwyżka = p1 , wypuszczenie gazu na zewnątrz odpowiada
rozprężeniu o V , rozprężeniu temu odpowiada spadek ciśnienia
(-p) q = p1
Przypuśćmy , że po wyrównaniu się temperatur nadwyżka ciśnienia wynosi p2 .
W porównaniu z ciśnieniem początkowym nastąpił spadek o p1-p2 , ale ten sam
spadek otrzymaliśmy rozprężając gaz izotermicznie o tę samą V zatem (-p) T = p1-p2 ze wzoru na adiabatę
(p) q/V = - p/V
z izotermy
(p) T/T = - p/V
porównując stronami znajdujemy
= (p) q/ (p) T
Ponieważ w obu przypadkach mamy te same wartości p i V to:
= p1/(p1-p2) = h1/(h1-h2)
2.Układ pomiarowy.
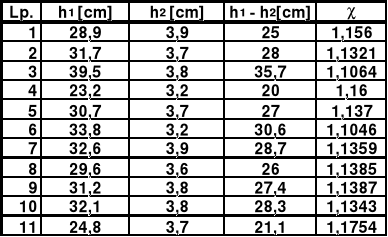
3. Tabela pomiarowa.
4.Opracowanie wyników
Na podstawie otrzymanych wyników obliczamy stosunek Cp/Cv ze wzoru:
= Cp/Cv = h1/(h1-h2)
Np. dla pomiaru pierwszego otrzymujemy:
= 28,9/(28,9 - 3,9) = 1,156
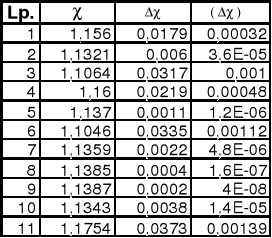
Wartość średnia tego stosunku dla wszystkich pomiarów wynosi:
= 1/n· i = 1,1381
Błędy pomiarowe obliczamy metodą Gaussa.
obliczamy błędy poszczególnych pomiarów ( wyniki w tabeli ) ze wzoru:
i = - i
Dla pierwszego pomiaru mamy:
i = 1,1381 - 1,156 =0,0179
obliczamy sumę kwadratów błędów poszczególnych pomiarów
( i )2 = 0,0043
obliczamy średni błąd kwadratowy wartości średniej
= ( i )2/n· (n-1)
= 0,0043/ 11· (11-1) = 0,0062
Ostateczny wynik stosunku Cp/Cv podajemy w postaci:
=
czyli:
= 1,1381 0,0062
Jest to najbardziej prawdopodobny wynik serii pomiarów.
5. Uwagi i spostrzeżenia.
Błąd w głównej mierze spowodowany jest mylnymi odczytami wysokości słupa
wody oraz nieszczelnością układu pomiarowego ( w założeniu przemiana adiabatyczna zachodzi bez wymiany ciepła z otoczeniem ).
Niepewność odczytu wynika ze skończonej wartości grubości podziałki na przyrządzie pomiarowym ( miara krawiecka ) oraz przyciąganie między cząsteczkowym , które powoduje powstawanie na powierzchni cieczy . Niemożliwe więc było jednoznaczne ( w każdym z 11 pomiarów ) określenie wysokości słupa wody co spowodowało powstanie odchyłek w przeprowadzonych pomiarach .
Porównanie otrzymanego wyniku z wartością tablicową.
Cząstki jednoatomowe mają trzy stopnie swobody , odpowiadające trzem wzajemnie prostopadłym translacjom x,y,z , a więc dla gazów a więc dla gazów jednoatomowych :
= 5/3 = 1,67
Cząstki dwuatomowe mogą ponadto wykonywać obroty wokół dwóch wzajemnie prostopadłych osi i drgania łączącej oba atomy . Czyli mają 6 stopni swobody ( 3 translacje , 2 rotacyjne i 1 oscylacyjny ) . A zatem dla gazów dwuatomowych przy załorzeniu . że cząstki nie wykonują oscylacji :
= 7/5 = 1,4
Załorzenie powyższe jest uzasadnione , ponieważ w temperaturach pokojowych ruchy oscylacyjne dla większości lekkich cząstek dwuatomowych są całkowicie "zamrożone" . Uruchomienie iscylacji w wyższych temperaturach powoduje obniżenie wartości , natomiast zamrożenie ruchów rotacyjnych cząstki występującej w niższych temperaturach prowadzi do wzrostu wartości
Ponieważ powietrze z większości składa się z tlenu i azotu można przyjąć że wartość dla powietrza wynosi 1,4 .
Natomiast dla powietrza wyznaczone doświadczalnie wynosi :
1,13810,0062
W rzeczywistości otrzymana doświadczalnie wartość jest różna od przewidywań teorii . Wynika to z wielu uproszczeń występującyh w tej klasycznej metodzie kinetyczno - cząstkowej teorii. Jak wiadomo teoria ta nie uwzględnia rotacyjnych stopni swobody atomów w cząsteczce . Nie uwzględnia także elektronowych ijądrowych stopni swobody w atomie . Wpływ może mieć także fakt że powietrze oprócz azotu itlenu składa się dodatkowo z 1%innych gazów .
Wyszukiwarka
Podobne podstrony:
FIZ OP~6, Zjawisko nak˙adania si˙ 2 lub wi˙cej fal nazywamy zjawiskiem interferencji
FIZ ME~4, Sprawozdanie z fizyki
FIZ ME~4, Sprawozdanie z fizyki
Fiz me~1, LABORATORIUM Z FIZYKI
FIZ ME~7
FIZ ME~2, Wprowadzenie teoretyczne
ME auctions ppt
5 3 FIZJOLOGIA W FIZ
6
Fiz kwantowa
ME 2 6 funkcje
ME zadania (1)
mat fiz 2008 10 06
6
więcej podobnych podstron