Cząstki elementarne, jądra atomowe, przemiany promieniotwórcze
Wymień poziomy ziarnistości materii.
Jakie cząstki, wg aktualnego stanu wiedzy, nie posiadają struktury subtelnej?
Podaj charakterystykę kwarków.
Podaj charakterystykę leptonów.
Wymień cząstki elementarne będące hadronami.
Zwięźle scharakteryzuj mezony i bariony.
Wymień i omów podstawowe wielkości które stosuje się do opisu cząstek elementarnych.
Czym różnią się fermiony od bozonów? Podaj przykłady.
Wymień i omów krótko trwałe cząstki fundamentalne.
Podaj charakterystykę protonu, neutronu.
Korzystając z www.przygodazczastkami.org/ zapoznaj się z modelem standardowym.
Wymień podstawowe rodzaje oddziaływań w strukturze materii i podaj ich krótką charakterystykę - zasięg oddziaływań, cząstki pośredniczące, cechy cząstek ulegających tym oddziaływaniom.
Podaj krótką charakterystykę cząstek pośredniczących w oddziaływaniach.
Podaj równania reakcji rozpadu cięższych leptonów. Jakie oddziaływania są odpowiedzialne za te procesy?
Jakie rodzaje oddziaływań występują w jądrach atomowych, omów je krótko.
Naszkicuj wykres zmian potencjału jądrowego (Saxona-Woods'a) elektrostatycznego w funkcji odległości dla protonów i neutronów.
Omów model kroplowy jąder atomowych.
Jakie czynniki decydują o małej energii wiązania nukleonów w najlżejszych jądrach atomowych?
Podaj najistotniejsze przyczyny nietrwałości ciężkich jąder atomowych (w oparciu o model kroplowy).
Jak można obliczyć średnią energię wiązania nukleonów w jądrze atomowym? Jakie dane są potrzebne do obliczenia energii wiązania nukleonów w jądrze atomowym?
Korzystając z bazy danych ( http://atom.kaeri.re.kr/ton/nuc1.html ) oblicz średnią energię wiązania nukleonów w jądrze izotopu wapnia 40Ca.
Korzystając z bazy danych ( http://atom.kaeri.re.kr/ton/nuc1.html ) oblicz energię separacji neutronu oraz energie separacji protonu z jądra izotopu wapnia 40Ca), zinterpretuj wyniki.
Korzystając z bazy danych ( http://atom.kaeri.re.kr/ton/nuc1.html ) oblicz energię separacji neutronu oraz energie separacji protonu z jądra izotopu 4He, omów uzyskane wyniki..
Korzystając z bazy danych ( http://atom.kaeri.re.kr/ton/nuc1.html ) oblicz średnie energie wiązania nukleonów w serii izotopów węgla (Z=6, N -zmienne), porównaj uzyskane wartości z trwałością tych nuklidów.
Korzystając z bazy danych ( http://atom.kaeri.re.kr/ton/nuc1.html ) oblicz średnie energie wiązania nukleonów w szeregu izotonowym o N = 6, porównaj uzyskane wartości z trwałością nuklidów.
Korzystając z bazy danych ( http://atom.kaeri.re.kr/ton/nuc1.html ) oblicz średnie energie wiązania nukleonów izotopów sodu, porównaj uzyskane wartości z trwałością nuklidów, (zrób wykres trwałości izotopów).
Korzystając z bazy danych ( http://atom.kaeri.re.kr/ton/nuc1.html ) oblicz średnią energie wiązania nukleonów w szeregu izobarów o liczbie masowej A = 14, porównaj uzyskane wyniki z trwałością nuklidów.
Omów model powłokowy jąder atomowych.
Wyjaśnij na podstawie modelu powłokowego, które z jąder izotopów tlenu 15O, 16O, 17O posiadają moment magnetyczny.
W układzie (N - Z) przedstaw i omów naturalne przemiany promieniotwórcze.
W układzie (N - Z) podaj schemat przekształceń jądra radioaktywnego izotopu 126I, ulegającego różnym rozpadom: a) , b) wychwyt K, c) -, d) +.
Podaj równania reakcji jądrowych dla przekształceń jądra radioaktywnego izotopu 190Au, ulegającego kolejno przemianom: - + - .
Korzystając z bazy danych (http://atom.kaeri.re.kr/ton/nuc1.html ) na wykresie (N - Z) przedstaw z jakich nuklidów i w jakich przemianach mogą się tworzyć nuklidy 40Ca.
Korzystając z bazy danych (http://atom.kaeri.re.kr/ton/nuc1.html ) znajdź stabilne nuklidy kadmu i ich udział procentowy w naturalnym kadmie.
Jakie cząstki fundamentalne uczestniczą w przemianie - a jakie w +?
Korzystając z bazy danych ( http://atom.kaeri.re.kr/ton/nuc1.html ) przeanalizuj kilka szeregów izotopowych i określ jakim przemianom ulegają promieniotwórcze nuklidy zawierające niedomiar lub nadmiar neutronów w porównaniu ze stabilnymi izotopami.
Wyjaśnij pojęcia: okres połowicznego zaniku, stała rozpadu, średni czas życia, naturalne szeregi promieniotwórcze.
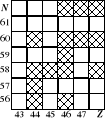
W oparciu o fragment klasyfikacji trwałych jąder atomowych (ścieżki stabilności) podaj równania prawdopodobnych reakcji rozpadu radioaktywnych izotopów 10445Rh i 10647Ag. Jaki rodzaj oddziaływań jest odpowiedzialny za te rozpady?Okres połowicznego rozpadu izotopu 218Po wynosi 3,03min. Oblicz średni czas życia jednego nuklidu tego izotopu.
Naturalny uran zawiera obok izotopu 238U (w ilości 99,27 %at) również izotopy 234U i 235U. Uran-238, macierzysty dla szeregu uranowo-radowego, ulega rozpadowi z okresem półtrwania T½ = 4,5·109 lat. Oszacuj zawartość radioaktywnego izotopu 234U, wiedząc, że ulega on rozpadowi z okresem półtrwania T½ = 2,5·105 lat.
Na podstawie wyników poprzedniego zadania, oblicz aktywność promieniotwórczą 1 g UO2 wyrażoną w bekerelach (okres półtrwania izotopu 235U wynosi 7,0·108 lat).
Radioaktywny izotop radu 226Ra (T½ =1600 lat) należy do promieniotwórczego szeregu uranowo-radowego. Korzystając z danych z zadania 40 oszacuj ile gramów RaSO4 można wydzielić z 1 tony naturalnego minerału uranu - uraninitu (UO2).
Elektrony w polu jąder atomowych
Zapoznaj się z następującymi zjawiskami fizycznymi: fale de'Broglie'a, dualizm korpuskularno-falowy, zjawisko Comptona, efekt fotoelektryczny, efekt Zeemana, efekt Starka, zakaz Pauliego, zasada nieoznaczoności Heisenberga, emisyjne widma spektralne atomów i jonów pierwiastków.
Energia wiązania elektronów przez jądra atomowe.
Co to jest równanie Schrödingera?
Co to są funkcje falowe elektronów?
Omów liczby kwantowe elektronu.
Jak rozumiesz pojęcie orbitalu?
Jakie wielkości fizyczne opisują liczby kwantowe elektronu w atomie wodoru?
Podaj możliwe wartości liczb kwantowych dla elektronów znajdujących się na orbitalach 1s, 2p, 3d, 4f.
Narysuj wykres składowej radialnej R(r) i kątowej Y(,) funkcji falowej dla elektronu znajdującego się na obritalach: 1s, 2p, 3d.
Narysuj wykres części radialnej R(r) i kątowej Y(,)funkcji falowej dla elektronu znajdującego się na obritalach: 3s, 3p, 3d.
Narysuj radialny [r2 R2 (r)] rozkład gęstości prawdopodobieństwa znalezienia elektronu znajdującego się na obritalach opisanych następującymi liczbami kwantowymi: (n = 1 , l = 0), (n=2, l=1). (n=3, l=2), (n=3, l=1).
Narysuj kontury orbitali d.
Czym różnią się elektrony znajdujące się na orbitalach 1s i 3s?
Rdzenie atomowe, właściwości rdzeni, pierwiastki chemiczne
Co to są rdzenie atomowe ?
Wymień typy walencyjne pierwiastków, w każdym podaj po dwa przykłady pierwiastków.
Podaj struktury rdzeniowo-walencyjne pierwiastków bloku sp.
Podaj struktury rdzeniowo-walencyjne pierwiastków bloku dsp.
Podaj struktury rdzeniowo-walencyjne pierwiastków bloku fdsp.
Wymień wszystkie pierwiastki strukturalnie wiodące i przypisz je do odpowiednich bloków.
Jakie liczby jednoznacznie opisują pierwiastki w rdzeniowej wersji układu okresowego?
Jakie liczby jednoznacznie opisują pierwiastki bloku sp w rdzeniowej wersji układu okresowego, podaj jakie przyjmują wartości ?
Jakie liczby jednoznacznie opisują pierwiastki bloku dsp w rdzeniowej wersji układu okresowego, podaj jakie przyjmują wartości ?
Jakie liczby jednoznacznie opisują pierwiastki bloku fdsp w rdzeniowej wersji układu okresowego, podaj jakie przyjmują wartości ?
Podaj znajdujące się w otoczeniu Sb osiem pierwiastków bloku sp, podaj struktury ich rdzeni.
Podaj znajdujące się w otoczeniu Mo pierwiastki bloku dsp, podaj struktury ich rdzeni.
Jak zmienia się elektroujemność rdzeniowa pierwiastków bloku sp?
Podaj charakterystykę elektroujemności rdzeniowej pierwiastków I serii dsp.
Podaj charakterystykę elektroujemności rdzeniowej pierwiastków I serii fdsp.
Podaj definicje elektroujemności wg Paulinga, Mullikena, Allreda-Rochowa.
Jak i dlaczego zmienia się promień rdzenia pierwiastków w I serii sp?
Co to jest polaryzowalność?
Podaj symbole, nazwy i przynależność do bloków pierwiastków o ładunku rdzeni +8.
Podaj symbole, nazwy i przynależność do bloków pierwiastków o ładunku rdzeni +5.
Podaj symbole, nazwy i przynależność do bloków pierwiastków o ładunku rdzeni +1.
Podaj symbole, nazwy i przynależność do bloków pierwiastków o ładunku rdzeni +2.
Podaj symbole, nazwy i przynależność do bloków pierwiastków o ładunku rdzeni +3.
Podaj symbole i nazwy kolejnych pierwiastków I serii dsp.
Podaj symbole i nazwy kolejnych pierwiastków I serii fdsp.
Korzystając z www.webelements.com, opisz sposoby otrzymywania pierwiastków o liczbach atomowych powyżej 105, wymień wszystkie pierwiastki których nuklidy otrzymano.
Trwałe drobiny jednordzeniowe
Co to jest drobina ?
Czym się różnią drobiny proste i złożone ?
Opis cyfrowy drobin - co to jest liczba ev i ez oraz n.
Drobiny trwałe i ich klasyfikacja.
Wymień trwałe drobiny jednordzeniowe wodoru i helu.
Wymień typy trwałych drobin jednordzeniowych pierwiastków bloku sp i podaj przykłady.
Wymień trwałe drobiny rdzenie pierwiastków bloku sp.
Wymień trwałe drobiny ośmioelektronowe pierwiastków bloku sp.
Wymień typy drobin jednordzeniowych pierwiastków bloku dsp i podaj przykłady drobin z każdego typu.
Wymień typy trwałych drobin jednordzeniowych pierwiastków bloku fdsp i podaj przykłady .
Rola strukturalna drobin jednordzeniowych w chemii.
Podaj z dokładnością do powłok struktury elektronowe drobin, wyróżnij struktury rdzeniowe i walencyjne: Li+ , Pb2+, Sb3+, Bi3+, Se2-, Br-, I-, Xe0, P3-, Te2-,Ge4-, Cr2+, Ni2+, Cu+, Pd2+, Mn2+, Fe2+, Ag+, Rh3+, Pt2+, Lu3+, Rb+, Ce4+, Th4+, Yb3+, Ce3+, Tb4+.
Podaj z dokładnością do podpowłok struktury elektronowe drobin, wyróżnij struktury rdzeni i struktury walencyjne: Li+ , Pb2+, Sb3+, Bi3+, Se2-, Br-, I-, Xe0, P3-, Te2-,Ge4-, Cr2+, Ni2+, Cu+, Pd2+, Mn2+, Fe2+, Ag+, Rh3+, Pt2+, Lu3+, Rb+, Eu2+, Ce4+, Nd3+, Th4+, Yb3+, Sm3+, Ce3+, Tb4+.
Podaj struktury elektronowe drobin (z dokładnością do podpowłok podaj struktury elektronowe rdzeni a walencyjne z dokładnością do orbitali): Li+ , Pb2+, Sb3+, Bi3+, Se2-, Br-, J-, Xe0, P3-, Te2-,Ge4-, Cr2+, Ni2+, Cu+, Pd2+, Mn2+, Fe2+, Ag+, Rh3+, Pt2+, Lu3+, Rb+, Eu2+, Ce4+, Nd3+, Th4+, Yb3+, Sm3+, Ce3+, Tb4+.
Jakimi liczbami kwantowymi opisane są elektrony walencyjne (w stanie podstawowym) stabilnych drobin cyny i żelaza.
Jakimi liczbami kwantowymi opisane są elektrony walencyjne (w stanie podstawowym) stabilnych drobin chromu i indu.
Które z pierwiastków pierwszej serii fdsp (od Cs do Yb) tworzą stabilne dwudodatnie kationy? Uzasadnij ich stabilność.
Które z pierwiastków pierwszej serii fdsp (od Cs do Yb) tworzą stabilne czterododatnie kationy? Uzasadnij ich stabilność.
Wyszukiwarka
Podobne podstrony:
Analiza techniczna gazow i wody, bio, Chemia, Biofizyka, Toksykologia, Wykład PWrocławska
Procesy dyfuzyjne, bio, Chemia, Biofizyka, Toksykologia, Wykład PWrocławska
Rownowaznik chemiczny, bio, Chemia, Biofizyka, Toksykologia, Wykład PWrocławska
Dynamika plynow, bio, Chemia, Biofizyka, Toksykologia, Wykład PWrocławska
Elektrochemia, bio, Chemia, Biofizyka, Toksykologia, Wykład PWrocławska
Elektrochemia1, bio, Chemia, Biofizyka, Toksykologia, Wykład PWrocławska
Definicje - analiza gazow, bio, Chemia, Biofizyka, Toksykologia, Wykład PWrocławska
Procesy spalania, bio, Chemia, Biofizyka, Toksykologia, Wykład PWrocławska
Zmiekczanie wody, bio, Chemia, Biofizyka, Toksykologia, Wykład PWrocławska
Wykład PŁ, bio, Chemia, Biofizyka, Toksykologia, Chemia i Technologia Wody
Laborki PŁ, bio, Chemia, Biofizyka, Toksykologia, Chemia Nieorganiczna i Ogólna
zielona chemia, BIOFIZYKA TOKSYKOLOGIA ANALITYCZNA POLIMEROW OLIMPIADY
Toksykologia wykład 6 Toksykologia uzależnień, Toksykologia Chemia sądowa
Toksykologia wykład 10 - toksykologia żywności, Toksykologia Chemia sądowa
w05, studia, bio, 5rok, 9sem, chemia produktów roślinnych, wykład
Toksykologia wykład 9 - Siarka, Toksykologia Chemia sądowa
Chemia w XX wieku, BIOFIZYKA TOKSYKOLOGIA ANALITYCZNA POLIMEROW OLIMPIADY
Toksykologia wykład 8 Toksykologia metali, Toksykologia Chemia sądowa
więcej podobnych podstron