Konrad Piątkiewicz wydział: Mechaniczny
ĆWICZENIE 24
WYZNACZANIE CIEPŁA TOPNIENIA LODU
Ciepło właściwe to wielkość określająca ilość energii jaką należy dostarczyć do danego ciała (o określonej masie), aby temperatura tego ciała wzrosła o jednostkę temperatury.
W układzie SI ciepło właściwe to wielkość określająca ilość energii jaką należy dostarczyć do pewnego ciała o masie jednego kilograma, aby jego temperatura wzrosła o jeden kelwin.
Natomiast ciepłem topnienia nazywamy ilość ciepła potrzebna do zmiany 1 kg ciała stałego danej substancji o temperaturze topnienia na ciecz o tej samej temperaturze.
Wynika z tego, ze Q=ctm (gdzie Q-ciepło potrzebne do stopienia danego ciała stałego o masie m, ct-ciepło topnienia tego ciała).
Na energię wewnętrzną ciała stełego składa się:
energia kinetyczna cząstek (związana z drganiami cieplnymi)
energia potencjalna wzajemnego oddziaływania cząstek.
Podczas podgrzewania ciała stałego można zauważyć zmianę jego objętości. Wynika to z tego, ze podgrzewając dostarczamy energii, którą przejmują cząsteczki ciała znajdujące się w sieci krystalicznej (drgają z coraz większą amplituda - potrzebują więcej miejsca) w efekcie tego objętość ciała wzrasta.
Podczas dalszego ogrzewania ciała dochodzi się do pewnej charakterystycznej temperatury (zwanej temperatura topnienia) w której zachodzi zjawisko topnienia - czyli proces przejścia ze stanu stałego ciała w stan ciekły. Ciekawe jest, ze towarzyszy temu stała temperatura. Jest to spowodowane tym, iż podczas tego zjawiska energia dostarczana przechodzi tylko w energie potencjalna oddziaływań cząstek między sobą i w wyniku tego zniszczone zostają wiązania miedzycząsteczkowe (ciało przechodzi w ciecz przy stałej temperaturze).
Okazuje się, ze temperatura topnienia zależy od ciśnienia w jakim ta przemiana następuje. Zależność tą oddaje równanie Clausiusa-Clapeyrona:
![]()
gdzie: T-temperatura przemiany przy ciśnieniu p
p-przyrost ciśnienia względem p
T-Przyrost temperatury przemiany spowodowany przyrostem ciśnienia o p
q-ciepło przemiany (np. ciepło topnienia)
V1,V2-objetosci ciała przed i po przemianie
Ciepło topnienia lodu wyznaczamy z bilansu cieplnego dla procesu stopienia pewnej ilości lodu w kalorymetrze:
![]()
- równanie bilansy cieplnego
gdzie: Q1-cieplo potrzebne do stopienia lodu
Q2-cieplo potrzebne do ogrzania powstałej z lodu wody
Q3-cieplo dostarczone przez wodę w naczyniu kalorymetrycznym
Q4-cieplo dostarczone przez kalorymetr z mieszadłem
Q5-cieplo dostarczone przez zanurzona część termometru (praktycznie zbiorniczek z rtęcią i szkło-oprawa termometru)
Przebieg ćwiczenia :
1. Zważyć puste, suche naczynie kalorymetryczne wraz z mieszadłem.
2. Wlać do około 2/3 objętości naczynia kalorymetrycznego lekko podgrzana wodę destylowana i zważyć. Obliczyć masę wody.
3. Naczynie kalorymetryczne z woda i mieszadłem wstawić do kalorymetru, odczytywać co minutę temperaturę.
4. Potłuc i osuszyć niewielka ilość lodu (około 1/4 objętości naczynia kalorymetrycznego).
5. Po upływie 6 minut od chwili rozpoczęcia pomiarów temperatury i otworzyć kalorymetr, wsypać przygotowany lód, zamknąć kalorymetr i mieszając wodę odczytywać temperaturę co 10-15 sekund. Gdy zmiany temperatury staną się ponownie niewielkie, temperaturę odczytywać jeszcze przez 5 minut w odstępach minutowych.
6. Wyjąc naczynie kalorymetryczne i zważyć je ponownie (razem z mieszadłem bez uchwytu oraz bez termometru).
7. W celu wyznaczenia pojemności cieplnej termometru zmierzyć objętość zbiornika rtęci używając malej menzurki.
8. Wyznaczyć (metoda graficzna, opisana w "Wiadomościach wstępnych o pomiarach kalorymetrycznych" (Skrypt - p.23.1)) temperaturę początkowa i końcową wody w kalorymetrze.
9. Obliczyć ciepło topnienia lodu.
10. Cale doświadczenie powtórzyć.
WARTOSCI STALE PRZYJETE DO OBLICZEN :
ciepło właściwe wody cw = (4185 +- 8) J/kg K
pojemność cieplna właściwa zbiornika z rtęcią termometru R = (1.93 +- 0.08)*1000000 J/kg K
ciepło właściwe kalorymetru :
aluminiowego (879 +-1) J/kg K
mosiężnego (390 +-1) J/kg K
miedzianego (380 +-1) J/kg K
szklanego (8.0 +-1) J/kg K
POMIARY :
1. Masa kalorymetru mk = 90.52 g = (0.09052 +- 0.00001)kg
2. Masa kalorymetru z woda m(k+w) = 354.3 g = (0.3543 +- 0.00001) kg
3. Masa wody mw = m(k+w) - mk = 354.3 - 90.52 = 263.78 g = (0.26378 +- 0.00001) kg
ostatecznie mw = (0.26378 +- 0.00001) kg
4. Pomiary temperatury wody i wody z lodem w kalorymetrze
Przed wrzuceniem lodu :
t [min] |
0 |
1 |
2 |
3 |
4 |
5 |
t [s] |
0 |
60 |
120 |
180 |
240 |
300 |
T[° C] |
43.4 |
43.2 |
43.0 |
42.9 |
42.8 |
42.6 |
Wrzucenie lodu - w czasie t = 330 s
Po wrzuceniu lodu (pomiar co 15 s) :
t [min] |
6 |
6.15 |
6.30 |
6.45 |
7.00 |
7.15 |
t [s] |
360 |
375 |
390 |
405 |
420 |
435 |
T[° C] |
29 |
27.8 |
27 |
26.6 |
26.4 |
26.4 |
Po wrzuceniu lodu (pomiar co 1 min) :
t [min] |
8.15 |
9.15 |
10.15 |
11.15 |
12.15 |
t [s] |
495 |
555 |
615 |
675 |
735 |
T[° C] |
26.4 |
26.5 |
26.6 |
26.6 |
26.6 |
5. Pomiar masy kalorymetru z woda i lodem: m(k+w+l) = 389.25 g = (0.38525 +- 0.00001)kg
masa lodu: ml = m(k+w+l) - m(k+w) = 389.25 - 354.3 = 34.95 g =(0.03495 +- 0.00001) kg
WYKRESY I OBLICZENIA:
1. Wykres procesu topnienia lodu przedstawiony jest na papierze milimetrowym.
2. Wyznaczenie ciepła topnienia lodu z równania bilansu cieplnego:
Po podstawieniach:
![]()
![]()
![]()
![]()
![]()
Otrzymałem:
![]()
Oznaczenia jakie przyjąłem:
cx ciepło topnienia lodu
m1 masa lodu
cw ciepło właściwe wody
mw masa wody w kalorymetrze
ck ciepło właściwe kalorymetru
mk masa kalorymetru z mieszadełkiem
R objętościowe ciepło właściwe szkła i rtęci
V objętość zanurzonej części termometru
T w temperatura początkowa wody w kalorymetrze
T k temperatura końcową układu
T t temperatura topnienia lodu równa 273.15 K
Teraz mogę wyliczyć ciepło topnienia lodu Cx :
![]()
Błąd Cx oblicze z różniczki zupełnej:
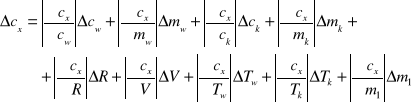
Wartości jakie przyjąłem do obliczeń:
ml = 0.043 95 kg ml = 0.000 02 kg
cw = 4185 J/kg K cw = 8 J/kg K
mw= 0.263 78 kg mw = 0.000 02 kg
ck = 879 J/kg K ck = 1 J/kg K
mk = 0.090 52 kg mk = 0.000 01 kg
R = 1 950 000 J/m3 K R = 80 000 J/m3 K
V = 0.000 000 25 m3 V = 0.000 000 02 m3
Tw = 315.55 K Tw = 0.2 K
Tk = 299.55 K Tk = 0.2 K
Tt = 273.15 K
(uwaga: zapis m3 oznacza metr sześcienny)
Z obliczeń:
![]()
Cx = 320 541.7584 J/kg

Cx = 12 453.92341 J/kg
Ostatecznie Cx=(320 500 +-12 500) J/kg
Błąd względny : ![]()
WNIOSKI :
Celem ćwiczenia było zmierzenie ciepła topnienia lodu. Pomiary dały wynik 320500 J/kg. Wartość ciepła topnienia podawana w tablicach fizycznych wynosi 340000 J/kg. Błąd bezwzględny wyniku to 12453 J/kg co jest spora wartością, lecz jako błąd względny daje ostatecznie 3.88 % (myślę, ze jest to nieźle).
Na wykresie topnienia (na papierze milimetrowym) widać, ze charakterystyka jest "zaokrąglona", nie ma tam kątów ostrych (teoretycznie - bez uwzględniania warunków praktycznych pomiaru powinny być ostre). Wynika to z bezwładności cieplnej wszystkich elementów biorących udział praktycznie w wymianie ciepła, wiec : kalorymetr, woda, termometr, mieszadełko kalorymetru, powietrze w kalorymetrze i poza nim, stół na którym stal kalorymetr. Największy wpływ na zaokrąglenie charakterystyki miały czynniki bezpośrednio stykające się z lodem.
Pomiar ciepła topnienia lodu był pośredni (nie można zmierzyć tego bezpośrednio - należy wyliczyć ze wzoru). W związku z tym, że wzór był dość rozbudowany i składał się z wielu zmiennych. Na błąd pomiaru wpływało wiele czynników takich jak :
dokładność pomiaru mas (kalorymetru, kalorymetru z woda, kolorymetru z woda i lodem)
dokładność pomiaru objętości pojemniczka z rtęcią w termometrze
dokładność pomiaru temperatury w rożnych chwilach
Spośród tych rożnych przyczyn największy wpływ na błąd miały : dokładność pomiaru temperatury końcowej całego układu i dokładność pomiaru temperatury początkowej wody w kalorymetrze. Generalnie na błędy najbardziej wpłyną pomiar temperatury.
Dodatkowo niedokładności mogły być związane z wymiana ciepła miedzy kalorymetrem, a powietrzem (niedokładne odizolowanie wewnętrznego naczynia kalorymetru od zewnętrznego). Pewną wymianę ciepła z otoczeniem dawał także termometr i mieszadełko kalorymetru.
��������������������������������������������������������������������������������������������������������������������������������������������������������
Wyszukiwarka
Podobne podstrony:
LF 25~1, Cz˙stotli-wo˙˙ drga˙ ˙r˙d˙a
D19210442 Rozporządzenie Ministra Skarbu z dnia 25 lipca 1921 r w przedmiocie przedłużenia zapisów
Żywy Płomień 582 Chcąc zachować swoją świętość, musicie eliminować wszelką pokusę natychmiast, gdy
1
1
Ustawa z dnia 25 06 1999 r o świadcz pien z ubezp społ w razie choroby i macierz
Cwiczenia 23 25 2007
X~1
Wykład 25
SEM18 ~1
Wykład12 Sieć z protokołem X 25 i Frame Relay
zwierzaczki 25
25 Wyklad 1 Dlaczego zwiazki sa wazne
wyklad 2012 10 25 (Struktury systemów komputerowych)
1
Wykład10a Sieć z protokołem X 25 i Frame Relay
więcej podobnych podstron