Egzamin z Fizyki Molekularnej
Fale materii. Równanie falowe. Równanie Schröedingera.
Funkcje falowe, prawdopodobieństwo.
Studnia potencjału, bariera potencjału, efekt tunelowy.
Zasada odpowiedniości Bohra. Poprzeć przykładami.
Zasada Heisenberga i jej znaczenie w spektroskopii.
Moment pędu w ujęciu kwantowym.
Spin, spino - orbita, zakaz Pauliego.
Metody rozwiązywania zagadnień kwantowych.
Metoda wariacyjna Ritza, metoda Hückla, wyznacznik sekularny.
Przybliżenie Bohrna - Oppenheimera. Jego konsekwencje w spektroskopii.
Teoria Heitlera - Londona. Całka kulombowska, rezonansowa, nakrywania.
Orbitale molekularne i atomowe.
Orbitale wiążące, antywiążące i niewiążące.
Klasyfikacja orbitali molekularnych.
Rodzaj wiązań molekularnych. Wiązania jonowe.
Rodzaj wiązań molekularnych. Wiązania homopolarne.
Rodzaj wiązań molekularnych. Wiązania wodorowe.
Wiązania koordynacyjne.
Wiązania van der Waalsa.
Rodzaje energii cząsteczki.
Statystyka Boltzmana w spektroskopii. Rozkład obsadzeń Boltzmana.
Cechy widma elektromagnetycznego.
Rodzaje spektroskopii i jej cele.
Energia rotacyjna. Spektroskopia rotacyjna.
Spektroskopia w podczerwieni. Badania strukturalne
Molekuła jako oscylator harmoniczny.
Oscylator anharmoniczny. Krzywa Morse'a.
Widma oscylacyjne a struktura molekuł. Tony posuwowe i nadtony.
Prawo Lamberta - Beera. Współczynniki Einsteina absorpcji.
Współczynniki Einsteina absorpcji i emisji. Znaczenie w spektroskopii.
Prawdopodobieństwo procesu absorpcji i emisji
Emisja spontaniczna i wymuszona.
Widma absorpcyjne stanów elektronowych.
Zasada Francka - Codnona.
Mechanizmy dezaktywacji wzbudzonych stanów elektronowych.
Procesy promieniste i niepromieniste. Schemat Jabłońskiego poziomów energetycznych.
Emisja spontaniczna. Reguła Kashy. Reguła Stockesa.
Konwersja wewnętrzną i przejścia międzysystemowe.
Fluoroscencyjna dezaktywacja elektronowych stanów wzbudzonych. Czas życia fluorescencji. Wydajność kwantowa fluorescencji.
Parametry charakteryzujące fluorescencję.
Rodzaje opóźnionej luminescencji.
Spektroskopia absorpcyjna, fluorescencyjna, fotoakustyczna i LIOAS.
Spektrofotometry absorpcyjne, fluorescencyjne, spektrometry fototermiczne.
Spektroskopia fourierowska.
1. Fale materii. Równanie falowe. Równanie Schröedingera.
Fale materii
Są zwane też falami de Broglie'a jest to, alternatywny w stosunku do klasycznego (czyli korpuskularnego), sposób postrzegania obiektów materialnych. Według hipotezy dualizmu korpuskularno-falowego każdy obiekt może być opisywany na dwa sposoby: jako cząstka/obiekt materialny albo jako fala (materii).
Pomysł opisu cząstek za pomocą fal pochodzi od Louisa de Broglie'a, który w 1924 roku uogólnił teorię fotonową efektu fotoelektrycznego. W tym czasie wiedziano już, że na potrzeby opisu niektórych zjawisk fizycznych, z każdą falą elektromagnetyczną można stowarzyszyć pewną cząstkę - foton. Propozycja De Broglie'a polegała na tym, aby każdej cząstce o różnym od zera pędzie przypisać falę, o określonej długości i częstości. Propozycja ta wychodziła naprzeciw wynikom eksperymentalnym, które świadczyły, że w pewnych sytuacjach każda cząstka może zachowywać się jak fala.
Zgodnie z tym, de Broglie zapostulował odwrócenie zależności wyrażającej pęd fotonu stowarzyszonego z falą elektromagnetyczną (zależności znanej z teorii fotonowej), czyli długość fali materii stowarzyszonej z cząstką miała wyrażać się przez pęd cząstki:
![]()
gdzie:
λ - długość fali ; h - stała Plancka ; p - pęd cząstki
Równanie falowe
Jest to matematyczne równanie różniczkowe cząstkowe drugiego rzędu, opisujące ruch falowy. Ma ono postać (w przestrzeni trójwymiarowej):
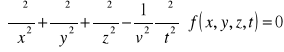
lub w skrócie z wykorzystaniem operatora d'Alemberta:
![]()
gdzie: ![]()
jest nieznaną funkcją,
v wektorem prędkości fali
x, y i z to składowe wektora położenia x.
Rozwiązaniem równania falowego jest funkcja f(x, y, z, t) w postaci:
![]()
gdzie funkcja g(x,y,z,t) jest ciągła i różniczkowalna odpowiednią ilość razy.
Rozwiązania te mają kształt zaburzenia zadanego co do kształtu funkcją g(x,y,z,0) przesuwającego się w kierunku zadanym przez wektor v z prędkością równą |v|.
Równanie Schröedingera
Jest podstawowym równaniem nierelatywistycznej mechaniki kwantowej, sformułowanym przez austriackiego fizyka Erwina Schröedingera w 1926 roku.
Opisuje ono ewolucję układu kwantowego w czasie.
W nierelatywistycznej mechanice kwantowej odgrywa rolę analogiczną do drugiej zasady dynamiki Newtona w mechanice klasycznej.
Najbardziej ogólna postać równania Schröedingera:
![]()
gdzie: ![]()
jest stałą Plancka podzieloną przez 2π
![]()
jest operatorem energii całkowitej, tzw. hamiltonianem układu,
![]()
jest funkcją położenia i czasu tzw. funkcją falową.
Hamiltonian układu:
Jest sumą dwóch operatorów, jeden jest operatorem energii kinetycznej, a drugi energii potencjalnej.
Dla pojedynczej nierelatywistycznej cząstki (V<<c) o masie m pozbawionej ładunku elektrycznego i spinu energia kinetyczna ma postać:
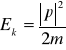
gdzie ![]()
jest operatorem pędu, zdefiniowanym w następujący sposób:
![]()
Energia potencjalna jest rzeczywistą funkcją skalarną, U = U(r).
Równanie Schröedingera zależne od czasu:
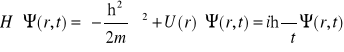
gdzie ![]()
Jest to najczęściej spotykana postać równania Schröedingera, jednak nie najbardziej ogólna.
Powyższe równanie jest cząstkowym równaniem różniczkowym, nazywanym też falowym równaniem Schröedingera.
Dokonując rozdzielenia zmiennych uzyskujemy równanie Schröedingera niezależne od czasu.
Równanie to stosuje się do tzw. stanów stacjonarnych (tj. takich w których energia nie zmienia się w czasie) i ma ono postać:
![]()
gdzie E jest energią układu
Analityczne rozwiązanie niezależnego od czasu równania Schröedingera
Jest możliwe tylko w najprostszych przypadkach. Jednak te najprostsze sytuacje pozwalają nam zagłębić się w naturę zjawisk kwantowych, a niejednokrotnie są one przybliżeniem bardziej złożonych zjawisk.
Kilka najbardziej typowych modeli pozwalających się rozwiązać analitycznie to:
cząstka swobodna
cząstka w pudle potencjału
cząstka w pierścieniu
rozpraszanie na barierze potencjalnej - efekt tunelowy
cząstka w potencjale sferycznie symetrycznym
kwantowy oscylator harmoniczny
atom wodoru
cząstka w jednowymiarowej sieci (potencjał periodyczny)
Dla orbitali atomowych:
Nie istnieje analityczne rozwiązanie. W takim przypadkach należy stosować przybliżone metody rozwiązywania równań różniczkowych, wśród których najpopularniejsze to:
rachunek zaburzeń
metoda Ritza
metoda Hartree-Focka
funkcje Greena równania Schröedingera
kwantowa metoda Monte-Carlo
2. Funkcje falowe, prawdopodobieństwo.
Funkcja falowa
To w mechanice kwantowej funkcja zmiennych konfiguracyjnych np. położenia, o wartościach zespolonych, będąca rozwiązaniem równania Schröedingera, opisująca stan kwantowy cząstki. Kwadrat modułu funkcji falowej jest proporcjonalny do prawdopodobieństwa znalezienia cząstki w stanie przez nią opisywanym. Ścisła definicja wymaga odniesienia się do własności przestrzeni Hilberta.
Same funkcje falowe i ich wartości nie są bezpośrednio mierzalne. Jako funkcja zespolona może być funkcja falowa przedstawiona w postaci iloczynu modułu i fazy i w odpowiednich warunkach dla niektórych układów możliwy jest pomiar różnic wartości faz funkcji falowych.
Bardziej ścisła definicja określa funkcję falową jako reprezentację w określonych współrzędnych (położenia, pędy, inne) pewnego wektora z abstrakcyjnej, na ogół nieskończenie wymiarowej, przestrzeni Hilberta stanów układu, wyposażonej obok iloczynu skalarnego także w relację równoważności, w której równoważne są elementy tzw. promienia, czyli wektory dające się wzajemnie rzutować na określony punkt sfery jednostkowej (funkcje falowe określone są z dokładnością do czynnika skali, fizyczny sens przyporządkowuje się tylko tym wektorom, dla których możliwe jest unormowanie do jedności). Kwadrat modułu wektora, obliczany przy użyciu zdefiniowanego dla przestrzeni Hilberta iloczynu skalarnego, jest proporcjonalny do prawdopodobieństwa zarejestrowania układu w stanie opisywanym tym wektorem falowym.
3. Studnia potencjału, bariera potencjału, efekt tunelowy.
Nieskończona studnia kwantowa
Nieskończona studnia kwantowa jest obiektem teoretycznym.
Potencjał bariery jest nieskończony, czyli cząstka o żadnej energii nie może przeniknąć w głąb bariery.
Cząstka w nieskończonej studni kwantowej nie może posiadać dowolnej energii, a jedynie energie postaci (poziomy energetyczne):
![]()
gdzie: n jest dowolną liczbą naturalną,
![]()
- stałą Plancka podzieloną przez 2π,
m - masą cząstki,
a - szerokością studni
Skończona prostokątna studnia kwantowa
W skończonej prostokątnej studni kwantowej potencjał bariery przyjmuje skończoną wartość i zmiana potencjału następuje skokowo.
W przypadku skończonej studni kwantowej również następuje dyskretyzacja energii, przy czym w studni musi się znajdować przynajmniej jeden poziom energetyczny
Inne rodzaje skończonych studni kwantowych
Oprócz studni prostokątnej wykonuje się również studnie paraboliczne, studnie schodkowe i inne.
Paraboliczna studnia kwantowa Schodkowa studnia kwantowa
Zastosowanie
Studnie kwantowe stosuje się jako obszar czynny w laserach półprzewodnikowych
Bariera potencjału
Jest to ograniczony obszar (zazwyczaj niewielki), w którym energia potencjalna cząstki (punktu materialnego) przyjmuje wartości większe niż w otoczeniu tego punktu.
W mechanice klasycznej:
Cząstka, której energia jest mniejsza od energii maksymalnej w barierze potencjału nie przejdzie przez barierę potencjału.
W mechanice kwantowej:
Przewiduje się istnienie efektu tunelowania polegającego na przenikaniu cząstek przez barierę potencjału, pomimo że mają energię mniejszą od wynikającej z mechaniki klasycznej.
Prawdopodobieństwo przeniknięcia cząstki przez barierę potencjału zależy od energii cząstki, wysokości i szerokości bariery. Cząstka o energii większej od wysokości bariery może zostać odbita przez barierę potencjału.
Współczynnik odbicia zwykle maleje wraz ze wzrostem energii cząstki, ale generalnie jest skomplikowaną funkcją energii.
Niektóre wartości energii mogą dać zerowe prawdopodobieństwo odbicia cząstki przez barierę.
Zjawisko przenikania cząstek przez barierę potencjału
Odgrywa bardzo ważną rolę i odpowiada za wiele zjawisk np.:
rozpad α jąder atomowych
emisję elektronów z zimnych metali pod wpływem silnego pola elektrycznego (emisja polowa)
niektóre reakcje chemiczne
Zjawisko tunelowe
Jest to zjawisko kwantowe przejścia cząstki przez barierę potencjału o wysokości (wartości energii potencjalnej) większej niż energia cząstki. To zjawisko, charakterystyczne dla mechaniki kwantowej, jest z punktu widzenia fizyki klasycznej paradoksem łamiącym klasycznie rozumianą zasadę zachowania energii.
Zjawisko to odpowiedzialne za wiele procesów szczególnie zachodzących z niewielką szybkością, zanim dany proces zajdzie ze znacznie większą szybkością gdy energia cząstek przekroczy barierę potencjału.
Zjawisku tunelowemu zawdzięczamy życie na ziemi gdyż fuzja jądrowa będąca źródłem energii Słońca zachodzi w warunkach zjawiska tunelowego. Energie zjonizowanej plazmy słonecznej są bowiem zbyt niskie aby pokonać barierę odpychania kulombowskiego jąder atomów wodoru. Bez zjawiska tunelowego jądra nie mogłyby sie zbliżyć wystarczająco aby połączyć się w jedno jądro. Na szczęście dzięki efektowi tunelowemu nie jest to wcale konieczne.
Eksperymentalnie zjawisko to zostało potwierdzone na początku lat 60-tych. We współczesnej technice dzięki zjawisku tunelowemu funkcjonują urządzenia takie jak dioda tunelowa czy skaningowy mikroskop tunelowy.
4. Zasada odpowiedniości Bohra (zasada korespondencji)
Mówi, że przewidywania każdej teorii kwantowej dotyczącej zachowania się jakiegoś układu fizycznego muszą odpowiadać przewidywaniom fizyki klasycznej w granicznym przypadku, gdy liczby kwantowe określające stan układu przybierają bardzo duże wartości.
Przykładowo dla modelu atomu Bohra
klasycznie można wyliczyć, że częstość promieniowania emitowanego przez elektron krążący po orbicie w atomie wodoru jest równa:
(*) 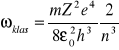
gdzie n jest numerem orbity.
Natomiast według mechaniki kwantowej:
(**) 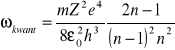
Łatwo sprawdzić, że granicą (**) wyrażenia przy n dążącym do nieskończoności jest wyrażenie (*).
5. Zasada Heisenberga i jej znaczenie w spektroskopii
Mówi, że niepewność zawsze będzie częścią każdego przewidywania dokonanego przez naukę. Postęp może ją tylko zmniejszać aż do pewnej granicy. Nieoznaczoność nigdy nie będzie równa zeru. Dla niektórych problemów nie da się dokładnie wyliczyć, co się stanie w przyszłości.
Matematyczna postać zasady
Zasada nieoznaczoności mówi, że nie można z dowolną dokładnością wyznaczyć jednocześnie położenia i pędu cząstki. Odkryta i sformułowana przez Wernera Heisenberga w 1927 roku, jest konsekwencją dualizmu korpuskularno-falowego.
Dla położenia i pędu:
![]()
gdzie:
![]()
- nieokreśloność pomiaru położenia (wariancja położenia),
![]()
- nieokreśloność pomiaru pędu (wariancja pędu),
Nie można z dowolną dokładnością wyznaczyć jednocześnie położenia nietrwałej cząstki i składowej pędu odpowiadającej położeniu
Dla energii i czasu:
![]()
gdzie:
![]()
- nieokreśloność pomiaru energii (wariancja energii),
![]()
- nieokreśloność pomiaru czasu (wariancja czasu),
Nie można z dowolną dokładnością wyznaczyć jednocześnie czasu życia nietrwałej cząstki i energii stowarzyszonej z nią fali de Broglie'a
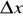
,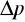
,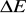
,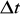
. nie są błędami pomiarowymi wynikającymi z niedoskonałości urządzeń lub metody pomiarowych, ale rozrzutami wyników (wariancją) wynikających z istoty samego pomiaru lub istoty samej mechaniki kwantowej (interpretacja Kopenhaska).
Z matematycznego punktu widzenia zasada nieoznaczoności jest konsekwencją braku komutacji operatorów położenia i pędu:
![]()
gdzie:
komutator [A,B]=AB - BA.
W mechanice kwantowej operatory opisujące wielkości fizyczne (obserwable) nie muszą komutować (być przemienne). Konsekwencją tego jest zasada nieoznaczoności. Zachodzi ona dla dowolnych dwóch obserwabli (A i B) gdy tylko [A,B] jest różne od zera.
Kwantowe implikacje
W świecie kwantowym nie ma możliwości dokładnego pomiaru jednocześnie położenia i pędu cząstki, gdyż każdy pomiar z samej swojej natury wpływa na badany obiekt, zmieniając jego właściwości. Można przewidywać jedynie średnie wyniki z serii wielu pomiarów. Ważne jest by podkreślić, że ![]()
,![]()
,![]()
,![]()
nie są błędami pomiarowymi wynikającymi z niedoskonałości urządzeń lub metod pomiarowych, ale niepewnościami wyników (wariancją) wynikających z istoty samego pomiaru.
Sam pomiar bowiem w przeważającej większości przypadków zmienia stan układu. Przykładowo, obserwując dany obiekt oświetlamy go fotonami. Im dokładniej chcemy zbadać położenie obiektu, tym krótsza musi być długość fali używanych do obserwacji fotonów. Fotony o krótszej długości fali niosą większą energię i pęd, a przez to bardziej zaburzają badany układ.
Stała Plancka![]()
wyznacza tu pewną charakterystyczną skalę. Obiekty, dla których długość fali jest zbliżona do ich wielkości, nabierają na skutek działania niesamowite własności. Przykładem może być tu elektron, który na skutek tunelowania, może przejść przez odpowiednio wąską barierę potencjału mimo, że jego energia jest mniejsza od wysokości tej bariery.
Jednak obiekty fizyczne znacznie większe od długości Plancka nie mają takich własności. Przykładowo, mrówka o masie 0.1g i długości 1 mm, która w czasie 1s pokonuje drogę 1mm ma pęd równy 0,1 g mm/s. Zgodnie z zasadą nieoznaczoności jej pozycję i pęd można równocześnie zmierzyć z dokładnością nie większą niż do 10 miejsca po przecinku. Taka dokładność jest zupełnie wystarczająca w codziennych doświadczeniach, dlatego efekty kwantowe nie są tu możliwe do zaobserwowania.
6. Moment pędu w ujęciu klasycznym i kwantowym
Moment pędu w mechanice klasycznej
Moment pędu (inaczej kręt) punktu materialnego A o masie m względem punktu O jest definiowany jako iloczyn wektorowy wektora o początku w O a końcu w A i pędu
![]()
Zachowanie momentu pędu jest konsekwencją symetrii obrotowej.
W płaszczyźnie prostopadłej do wektora momentu pędu wygodnie jest wprowadzić współrzędne biegunowe (
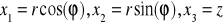
).
W takim układzie współrzędnych prostopadłym do płaszczyzny moment pędu ma składowe L={0,0,Lz} i ostatnia niezerowa składowa jest równa
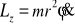
Jej stałość oznacza zachowanie prędkości polowej (drugie prawo Keplera) ![]()
W tym układzie współrzędnych kwadrat prędkości
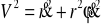
i energię układu fizycznego zapisać można jako:
![]()
gdzie: ![]()
jest efektywnym potencjałem.
Pierwsza jego część opisuje siłę odśrodkową (układ współrzędnych nie jest inercjalny) a druga część realną siłę (np. dośrodkową, np. grawitacyjną).
Moment pędu w mechanice kwantowej
W mechanice kwantowej operator momentu pędu jest zdefiniowany identycznie jak w mechanice klasycznej
![]()
teraz jednak p jest operatorem pędu: ![]()
Spełnia on takie same reguły komutacyjne jak w mechanice klasycznej ![]()
Kwadrat operatora momentu pędu ![]()
jest przemienny (jednocześnie mierzalny) z wszystkimi składowymi operatora momentu pędu ![]()
W układzie o symetrii sferycznej zachodzi znikanie komutatora ![]()
Konsekwencją tej symetrii jest prawo zachowania momentu pędu i jednoczesna mierzalność energii, kwadratu momentu pędu L2 i jednej z jego składowych (zwykle przyjmuje się Lz).
We współrzędnych sferycznych operator kwadratu momentu pędu L2 ma postać:
Równanie własne
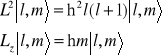
daje wartości własne ![]()
i funkcję własne ![]()
7. Spin, spino - orbita, zakaz Pauliego
Spin
Jest to własny moment pędu danej cząstki w układzie w którym cząstka spoczywa. Własny oznacza tu taki, który nie wynika z ruchu danej cząstki względem innych cząstek, lecz tylko z samej natury tej cząstki.
Każdy rodzaj cząstek elementarnych ma odpowiedni dla siebie spin.
jądra atomów - posiadają swój spin będący sumą wektorową spinów wchodzących w jej skład cząstek elementarnych.
Spin jest pojęciem czysto kwantowym.
W mechanice klasycznej gdy cząstka spoczywa nie może mieć niezerowego momentu pędu.
Układ spoczynkowy istnieje tylko gdy cząstka ma masę.
Gdy cząstka jest bezmasowa (np. foton) można jedynie określić rzut spinu na kierunek propagacji cząstki.
Matematycznie
Spin jest wielkością tensorową wynikającą z teorii kwantowej. Dokładnie jest to własność związana z tensorowym charakterem funkcji falowej, opisującej daną cząstkę, względem grupy obrotów.
Np. funkcja falowa pionów może być uważana za wektor, funkcja falowa hipotetycznych grawitonów miałaby być tensorem 2-giego rzędu, zaś funkcja falowa elektronów jest spinorem o rzędzie 1/2.
Obserwowane wartości spinu są wartościami własnymi operatora spinu. Aby dla danej cząstki otrzymać wartość jej spinu należy zadziałać tym operatorem na jej funkcję falową.
Dla elektronu, protonu czy neutronu liczba ta jest oznaczana symbolem "s" i może przyjmować wartość ułamkową 1/2.
Trzy składowe spinu elektronu są opisane macierzami Pauliego:
![]()
gdzie:
i={1,2,3},
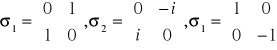
Reguła Pauliego (zakaz Pauliego)
Została zaproponowana przez Wolfganga Pauliego w 1925 dla wyjaśnienia zachowania się fermionów, czyli cząstek o spinie połówkowym. Reguła Pauliego jest szczególnym przypadkiem ogólniejszego twierdzenia o związku spinu ze statystyką.
Zakaz Pauliego głosi, że:
W danym stanie kwantowym może znajdować się jeden fermion - albo inaczej, że żadne dwa fermiony nie mogą w jednej chwili występować w dokładnie tym samym stanie kwantowym.
Zakaz Pauliego odgrywa ważną rolę przy opisie własności jąder atomowych i atomów.
Stanowi punkt wyjścia dla zasady rozbudowy powłok elektronowych oraz wyjaśnienia okresowości konfiguracji elektronowych atomów.
Reguła ta ma wielkie znaczenie w chemii i fizyce atomowej.
Szereg fundamentalnych własności materii jest jej wynikiem, gdyż materia jest zbudowana właśnie z fermionów, z których najczęściej spotykane to protony, elektrony i neutrony.
Na skutek "działania" reguły Pauliego żaden z dwóch fermionów nie może jednocześnie przebywać w tym samym miejscu, jeśli znajdują się w tym samym stanie kwantowym. W wielu przypadkach uniemożliwia to występowanie pewnych konfiguracji przestrzennych orbitali blisko położonych atomów czy cząsteczek.
W związku z tym atomy nie mogą przenikać się nawzajem w dowolny sposób, a w momencie zderzenia dwóch atomów dochodzi albo do ich połączenia w związek chemiczny, albo sprężystego odbicia.
Względna trwałość obiektów materialnych - z reguły Pauliego wynika, że wszelkie przemiany materii muszą być związane z jakimś efektem energetycznym, gdyż są zawsze związane ze zmianami stanów kwantowych tworzących je fermionów. Każda taka przemiana wymaga przekroczenia pewnej bariery potencjału energetycznego. Przemiany te zawsze podlegają regułom termodynamiki.
8. Metody rozwiązywania zagadnień kwantowych
Przybliżone metody rozwiązywania zagadnień kwantowych:
Energia molekularna dzieli się na:
Energię kinetyczną wszystkich jąder
Energię kinetyczną wszystkich elektronów
Hamiltonian molekuły:
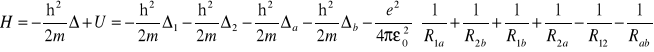
gdzie:
![]()
: energia kinetyczna elektronu e1
![]()
: energia kinetyczna elektronu e2
![]()
: energia kinetyczna protonu a
![]()
: energia kinetyczna protonu b
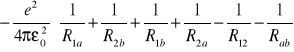
: energia oddziaływań pomiędzy
poszczególnymi cząstkami
9. Metoda wariacyjna Ritza. Metoda Huckla, wyznacznik sekularny
Metoda wariacyjna Ritza:
Funkcja falowa jest liniową kombinacją wybranych funkcji fc
![]()
![]()
- współczynnik wariacyjny (udział elektronów w wiązaniu)
![]()
- funkcja falowa molekuły
Metoda kombinacji liniowych orbitali [LCAD]:
![]()
![]()
- kombinacja funkcji związana z elektronem e1
![]()
- kombinacja funkcji związana z elektronem e2
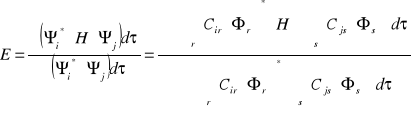
Zmiana oznaczeń (rotacja Heisenberga):
Całka rezonansowa:
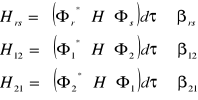
(gdy ![]()
i ![]()
)
Całka nakrywania:
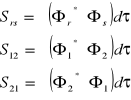
(wzajemne przenikanie orbitali atomowych)
Całka kulombowska:
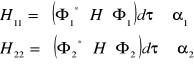
odpowiada energii elektrycznej, którego ruch opisany jest odpowiednio funkcjami ![]()
i ![]()
(oddziaływanie elektronu z macierzystym protonem)
Równanie sekularne:
![]()
dla r=1 ![]()
dla r=2 ![]()
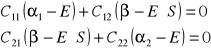
![]()
i ![]()
energia atomów wchodzących w skład molekuły
Wyznacznik sekularny:
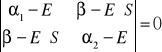
![]()
mamy dwa rozwiązania:
E1 - molekuła silnie związana
![]()
- molekuły są trwałe w tym stanie
![]()
- molekuły w tym stanie są nietrwałe, ale istnieją
Najmniejsza energia przybliża energię najniższego stanu energetycznego molekuły.
Jeśli ![]()
i ![]()
to molekuła istnieje w wyniku innych wiązań, ale mamy stan niewiążący.
Metoda LCAO (Linear Combination of Atomic Orbitals):
Molekułę traktujemy jako twór zbudowany z atomu, dla którego funkcję falową można opisać najprostszym modelem orbitali atomowych (każdemu elektronowi przypisuje się jedną Orbitale tzw. własną funkcje falową)
Funkcję falową można dokładnie określić tylko dla atomu wodoru, dla innych pierwiastków są tylko przybliżone.
Zgodnie z zakazem Pauliego postać każdego orbitalu
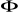
może przybierać dwie formy (związane ze spinem)
i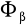
.
10. Przybliżenie Bohrna - Oppenheimera
Z uwagi na to, że masa protonu mp~1840 me więc przy rozwiązywaniu równania Schröedingera uznajemy, że ruch protonów jest tak powolny w porównaniu z ruchem elektronów, że możemy je pominąć. W konsekwencji energia elektronów odpowiada danej ustalonej odległości między jądrami.
Hamiltonian: 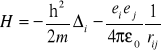
11. Teoria Heitlera-Londona. Całka rezonans., kulomb. i nakrywania
Całka rezonansowa:
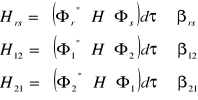
(gdy ![]()
i ![]()
)
Całka nakrywania:
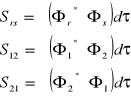
(wzajemne przenikanie orbitali atomowych)
Całka kulombowska:
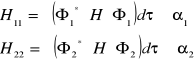
odpowiada energii elektrycznej, którego ruch opisany jest odpowiednio funkcjami ![]()
i ![]()
(oddziaływanie elektronu z macierzystym protonem)
12. Orbitale molekularne i atomowe
Orbital :
Jest to falowa, będąca rozwiązaniem równania Schröedingera dla szczególnego przypadku układu jednego elektronu znajdującego się na jednej z powłok atomowych lub tworzących wiązanie chemiczne
Orbital jest funkcją falową jednego elektronu, której kwadrat modułu określa gęstość prawdopodobieństwa napotkania elektronu w danym punkcie przestrzeni.
Pojęcie orbitalu jest często utożsamiane z kształtem obszaru, obliczonym z funkcji orbitalowej, w którym prawdopodobieństwo napotkania elektronu jest bliskie 1 (zwykle przyjmuje się wartość 0,9). Obszar ten jednak nie jest orbitalem w sensie teorii kwantowej, gdyż w terminach tej teorii orbital to funkcja, opisująca rozkład prawdopodobieństwa napotkania elektronu.
Rodzaje orbitali zależą od liczby kwantowej momentu pędu:
Funkcje opisujące Orbitale:
Funkcje wiążące - zgodne w fazie (elektrony pomiędzy jądrami - bardzo silne wiązanie)
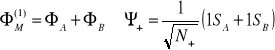
Funkcje antywiążące - elektrony nie mogą zrównoważyć efektu odpychania jąder.
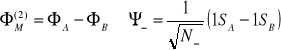
N+ (-) - czynnik dodatni (ujemny)gęstości prawdopodobieństwa opisujący średnią gęstość prawdopodobieństwa między jądrami, gdy elektrony są identyczne.
Orbitale dzielimy na:
orbitale atomowe - orbitale te opisują wszystkie elektrony, które w danym momencie nie uczestniczą w tworzeniu wiązań chemicznych ale są przypisane do określonych jąder atomowych.
orbitale molekularne - orbitale te opisują elektrony w cząsteczce, które w danym momencie mogą (ale nie muszą) tworzyć wiązania chemiczne. Orbitale molekularne dzielą się z kolei na:
orbitale wiążące - w których elektrony posiadają niższą energię niż gdyby przebywały na swoich orbitalach atomowych i nie uczestniczyły w tworzeniu wiązania
orbitale antywiążące - w których elektrony posiadają wyższą energię niż gdyby przebywały na swoich orbitalach atomowych.
orbitale niewiążące - w których elektrony posiadają taką samą energię jak gdyby przebywały na swoich orbitalach atomowych.
Z orbitali atomowych powstają orbitale molekularne:
s ![]()
p ![]()
d ![]()
Kształty orbitali
Kształty orbitali opisujących dany elektron w atomie lub cząsteczce zależą od usytuowania tych elektronów względem jąder oraz innych elektronów, które z kolei wynikają z liczb kwantowych przypisanych do danego elektronu. Usytuowanie to jest nazywane konfiguracją elektronową:
Kształty orbitali w funkcji liczb kwantowych
Wśród orbitali atomowych wyróżnia się:
orbitale s - o kształcie sferycznym
orbitale p - o kształcie "hantli"
orbitale d i f - o bardziej złożonych kształtach w których występuje
kombinacja "hantli" i torusów.
Orbitale molekularne, wiążące dzieli się najczęściej na:
orbitale σ - które powstają w wyniku czołowego nałożenia się
orbitali s lub p
orbitale π - które powstają w wyniku bocznego nałożenia się
orbitali p, d lub f
14. Klasyfikacja orbitali molekularnych
Geometria orbitali molekularnych jest przybliżoną sumą bądź różnicą orbitali atomowych.
Dla orbitali wiążących energia molekuły obniża się w stosunku do energii atomu, a elektrony mają największą gęstość w przestrzeni międzyjądrowej - efekt stabilizujący.
Z uwagi na symetrię
Z uwagi na stopień delokacji
Z uwagi na energię
Wiążące
Antywiążące (stan wzbudzony)
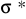
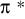
Orbitale molekularne antywiążące przyjmują szereg, nieraz bardzo złożonych kształtów, które trudno jest opisać i narysować (między innymi dlatego, że są tworami "wirtualnymi", nie zawsze mają jakąkolwiek interpretację).
Niewiążące
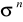
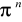
Zapełnianie orbitali przez elektrony przebiega zgodnie z zakazem Pauliego.
Dany orbital (poziom energetyczny) może pomieścić co najwyżej dwa elektrony o różnym spinie co stanowi podstawę budowy układu okresowego pierwiastków.
Typy wiązań:
Typu
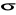
:Powstają z orbitali typu 1s i 2s :
Typu
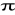
:
Aby utworzyć molekułę orbitale muszą być wzajemnie prostopadłe.
A
Diagram energetyczny:
![]()
zgodnie z teorią Bohra atom nie pochłonie każdego promieniowania (przejścia pomiędzy stanami).podobnie jest z molekułami wiążącymi tylko niektóre kwanty energii.
Energia orbitali:
Gdy molekuła jest w stanie podstawowym to jej elektrony są na orbitalach wiążących, a w stanie wzbudzonym elektrony są na orbitalu antywiążącym.
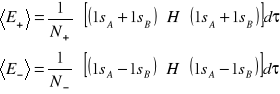
Aby uzyskać efekt wiążący należy zachować warunki:
Orbitale molekularne użyte do kombinacji orbitali atomowych powinny mieć porównywalna energię.
Orbitale atomowe powinny się efektywnie nakładać.
Orbitale atomowe tworzące orbitale molekularne powinny mieć taką samą symetrię względem osi łączącej jądra w molekule.
15. Wiązania Jonowe
Powstają przez oddziaływanie dwóch jonów (jeden łatwo traci a drugi łatwo zyskuje) oraz gdy różnica elektroujemności wynosi niej niż 1.7 np. między atomem sodu Na (0.9) i chloru Cl (0.3). Gdy dwa atomy znajda się obok siebie pierwiastek bardziej elektroujemny (Cl) odbiera mniej elektroujemnemu (Na) elektron z jego powłoki walencyjnej i przyłącza do swojej.
Na + Cl Na+ + Cl- Na+ Cl-
Kation z anionem przyciągają się na zasadzie prostego oddziaływania elektrostatycznego.
Atomy I, II, III grupy mają charakter elektrododatni (łatwo tworzy kationy), maja odpowiednio 1, 2, 3 elektrony walencyjne (łatwo odrywają elektrony)
Atomy IV, V grupy przyjmują elektrony w celu całkowitego zapełnienia powłok lub oddają je. Np.:
PH3 (Fosfor przyłącza 3 elektrony oddane od wodoru - akceptor)
PCl5 (Fosfor oddaje 5 elektronów na koszt chloru - donor)
Atomy VI, VII grupy mają charakter elektroujemny (łatwo przyciągają elektrony).
Warunek energetyczny powstania molekuły (EAB < EA, EB)
Ujemne wartości energii EAB oznacza, że powstała molekuła.
Mechanika powstawania wiązania jonowego KCl.
Konfiguracja elektronowa jonów K i Cl jest taka sama jak argonu o symetrii sferycznej. Podczas zbliżania się jonów, Cl wykonuje pracę przeciwko siłom przyciągania i następnie obniża energię układu kosztem pracy.
![]()
wzór słuszny gdy odległość między jonami nie wyniesie ![]()
.
K i Cl mają zapełnione wszystkie stany a ich powłoki są zajęte, zatem dla R<R0 dwa elektrony musiałyby zajmować identyczny stan, co jest niezgodne z zakazem Pauliego. Dlatego część elektronów przechodzi w stan wolny o wyższej energii (energia układu U(R) wzrasta, co wiąże się z istnieniem sił odpychania).
Dowody doświadczalne istnienia wiązania jonowego
Istnienie momentu dipolowego.
Równoległe ustawienie się molekuł w stosunku do linii sił pola elektrycznego.
Pomiar przenikalności elektrycznej gazów molekuł jonowych.
16. Wiązanie Homopolarne (Kowalencyjne)
Polega na dążeniu jednakowych atomów do uzupełnienia powłoki walencyjnej poprzez uwspólnienie elektronów walencyjnych.
Np.:
Wiązanie kowalencyjne spolaryzowane
Tego typu wiązania tworzą się miedzy różnymi atomami podobnej elektroujemności. Powstaje wtedy wspólna para elektronów. Elektrony atomów o mniejszej ilości elektronów walencyjnych przechodzą w stronę drugiego atomu. Dzięki temu jeden atom jest lekko elektrododatni drugi lekko elektroujemny.
17. Wiązania Wodorowe
Oddziaływanie miedzy kowalencyjnie związanym atomem wodoru a atomem silnie elektroujemnym dysponującym wolna parą elektronów.
Ma charakter wiązania jonowego. Wodór traci swój elektron na korzyść elektroujemnego atomu i sam występuje w postaci protonu (energia wiązania ~ 0.1 eV)
Wiązanie wodorowe warunkuje szereg właściwości wodoru (H2O, wiązanie protein, DNA)
Stabilizuje kształt molekuł.
Podwyższa temperaturę topnienia kryształów.
Podwyższa temperaturę wrzenia cieczy.
18. Wiązania Koordynacyjne
Są pewną formą wiązania kowalencyjnego. Różnią się tym, że wiązania tworzą się z elektronów pochodzących z jednego pierwiastka.
19. Wiązania van der Waalsa
Przyczyną powstawania tego rodzaju wiązań są siły van der Waalsa (mają one charakter sił elektrostatycznych). Co najważniejsze, molekuły nie tracą swoich indywidualnych cech.
Są to słabe wiązania występujące w słabych kryształach które mają:
Niskie temperatury topnienia (łatwo można je zniszczyć).
Wysokie temperatury wrzenia.
Małą wytrzymałość mechaniczną.
Mechanizm sił van der Waalsa
Wiązania zorientowane:
Typ wiązań silnych (dwie molekuły polarne)
Molekuły muszą posiadać trwały moment dipolowy
Tworzenie kryształów molekularnych przeciwdziałają ruchy cieplne:
W niskiej temperaturze:
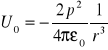
W wysokiej temperaturze:
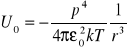
kT - energia cieplna
p - moment dipolowy
Wiązania indukowane:
Typ wiązań słabych
Jedna molekuła polarna oddziałuje na molekułę niepolarną (gdy znajdują się w dużej odległości od siebie nie ma oddziaływań, lecz gdy są blisko siebie następuje polaryzacja i w drugiej molekule indukuje się moment dipolowy)
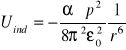
szybko maleje wraz z odległością
![]()
α - polaryzowalność molekuły (zdolność molekuły do przemieszczania ładunków wewnątrz swojej struktury)
Wiązania dyspersyjne:
Gdy
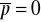
mamy symetrię, lecz ciągły ruch elektronów daje chwilowe odstępstwa od tej reguły i pojawia się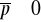
(siły przyciągania lub odpychania)Molekuły nie mają momentu dipolowego (indukują go sobie nawzajem)
Energia całkowita wiązań van der Waalsa:
![]()
gdy nie ma momentu dipolowego to ![]()
20. Rodzaje energii cząstek
Wszystkie rodzaje energii (oprócz translacyjnej) są skwantowane, można więc badać ich właściwości spektralne.
![]()
kombinacja liniowa wszystkich energii
Energia translacyjna (ET)
Określa średnią energię kinetyczną molekuły w układzie (nie jest skwantowana). Zgodnie z zasadą ekwipartycji energii dzielicie równomiernie na wszystkie stopnie swobody.
![]()
Średnia energia kinetyczna translacji molekuł nie zależy od wielkości i masy danej molekuły.
![]()
- dla 1 mola
Energia rotacyjna (ER)
Wynika z wirowania molekuły wokół własnej osi. Ruch ten można rozłożyć na składowe rotacje wokół trzech osi wzajemnie do siebie prostopadłych, czyli przypisać mu trzy stopnie swobody. Na każdy stopień przypada pewna ilość energii rotacyjnej. Jeżeli wszystkie molekuły leżą na linii prostej to rotacja wokół tej osi ma tak małą energię, że ją zaniedbujemy. Molekuły liniowe mają więc tylko 2 stopnie swobody rotacji.
W wysokich temperaturach ok. 400-5000C stosujemy zasadę ekwipartycji energii, przyjmując, że na każdy stopień swobody przypada energia rotacji równa:
![]()
Energia rotacyjna dla HF i CO2 jest większa niż energia H2O.
Energia oscylacyjna (EO)
Atomy w molekule są połączone wiązaniami utworzonymi przez elektrony walencyjne. Wiązania te zachowują się jak sprężyny, które wiążą zręby atomowe (jądra otoczone zamkniętymi powłokami elektronów nie biorących udziału w wiązaniu)
Gdyby atomy tworzące molekułę były swobodne, posiadałyby 3 stopnie swobody ruchu translacyjnego, czyli n atomów miałoby 3n stopni swobody. Jednak atomy w molekule są związane, nie mogą więc wykonywać samodzielnych translacji więc w przestrzeni przemieszcza się cała molekuła:
translacje - 3 stopnie swobody
rotacje - 3 stopnie swobody dla molekuł nieliniowych
- 2 stopnie swobody dla molekuł liniowych
oscylacje wewnątrz molekuły:
![]()
dla molekuł nieliniowych
![]()
dla molekuł liniowych
Energia elektronowa (EE)
Jest to energia kinetyczna ruchu elektronów w molekule i energia potencjalna przyciągania elektronów przez jądra i odpychania ich przez sąsiednie elektrony. W przypadku tej energii nie przyporządkowuje się stopni swobody gdyż jest to skomplikowane i mało użyteczne. Łagodnie przechodzi ona w energię oscylacyjną.
Porównanie energii:
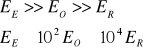
21. Rozkład obsadzeń Boltzmanna
Opisuje stan równowagi termodynamicznej (nie dotyczy elektronów liczby molekuł)
Gdy w badanym układzie panuje jednakowa temperatura w każdym elemencie objętościowym i molekuła nie otrzymuje energii z zewnątrz to obsadzenie poziomów energetycznych jest opisane funkcją rozkładu Boltzmanna.
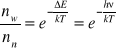
Przypadki szczególne:
![]()
wtedy ![]()
(poziomy się przykrywają) lub ![]()
(niemożliwe termicznie)
Im bliżej siebie leżą tym obsadzenie poziomów jest wyrównane.
![]()
wtedy ![]()
lub ![]()
Im bardziej odległe poziomy energetyczne lub im niższa temperatura tym słabiej jest obsadzony poziom o najniższej energii.
![]()
wtedy ![]()
(możliwe tylko wtedy gdy nie mamy równowagi termicznej)
Obsadzenie poziomu wyższego nie może być większe od obsadzenia poziomu niższego. Gdy ![]()
mamy do czynienia z akcją laserową (w stanie równowagi termicznej molekuły przekazują sobie energię i zmieniają obsadzenie poziomów)
22. Cechy widma elektromagnetycznego
Energia może być wyrażona przez:
Długość fali
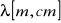
Częstotliwość fali
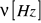
Częstość drgań na centymetr
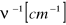
Zakresy energetyczne:
Energia elektronowa - UV, VIS
Energia oscylacyjna - podczerwień
Energia rotacyjna - mikrofale
23. Rodzaje spektroskopii
Zadania aparatury pomiarowej:
Analiza jakościowa (zależność natężenia promieniowania w funkcji energii)
Analiza ilościowa (liczba fotonów o danej długości fali oddziałujących z materią)
Podział spektroskopii (3 kryteria podziału):
Pochłanianie lub emisja promieniowania:
Spektroskopia absorpcyjna
Spektroskopia emisyjna
Spektroskopia rozpraszania (widmo Ramana)
Formy energii molekuł, która na skutek skwantowania stwarza możliwości przejść miedzy poziomami energetycznymi:
Spektroskopia elektronowa (może być absorpcyjna lub emisyjna)
Spektroskopia oscylacyjna
Spektroskopia rotacyjna
Spektroskopia EPR (elektronowy rezonans paramagnetyczny)
Spektroskopia NMR (jądrowy rezonans magnetyczny)
Zakres widmowy :
Spektroskopia w nadfiolecie
Spektroskopia obszaru widzialnego
Spektroskopia w podczerwieni
Spektroskopia mikrofalowa
Radiospektroskopia
Spektroskopia EPR
Spektroskopia NMR
24. Energia rotacyjna. Spektroskopia rotacyjna
Energia rotacyjna
Klasycznie:
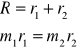
Energia ruchu obrotowego:
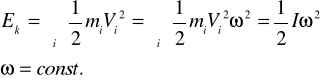
zmienia się w sposób ciągły
Kwantowo:
![]()
![]()
, ![]()
![]()
masa związana ze środkiem masy
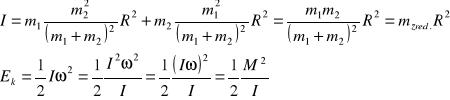
Rotacja w ujęciu kwantowym:
Moment pędu M i energia E są skwantowane.
![]()
dla J=0, 1, 2…
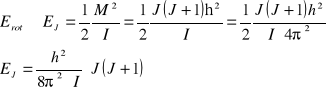
![]()
stała rotacji charakterystyczna dla danej molekuły
![]()
![]()
Wartość energii rotacji dla poszczególnych J:
Dla J = 0 Erot = 0 B , Dla J = 1 Erot = 2 B
Dla J = 2 Erot = 6 B , Dla J = 3 Erot = 12 B
Różnica pomiarów poziomów energetycznych:
![]()
Poziomy rotacyjne są coraz bardziej odległe w miarę wzrostu liczby kwantowej J.
Przejścia między poziomami:
J = 0 J = 1 => ![]()
J = 1 J = 2 => ![]()
J = 2 J = 3 => ![]()
Reguła wyboru dla przejść rotacyjnych:
![]()
![]()
Na podstawie widm rotacyjnych uzyskujemy informacje strukturalne o molekułach.
Poprzez stałą B możemy obliczyć
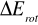
zależne od momentu bezwładności molekuły.Dla molekuł o większym B (mniejszym I) maksymalne obsadzenia przypadają dla najniższej wartości J.
Niskoenergetyczne poziomy rotacyjne leżą poniżej energii kT
Informacje z widma rotacyjnego:
Z widma rotacyjnego możemy oszacować B z odległości pomiędzy poziomami (2B). Gdy znamy B możemy oszacować moment bezwładności molekuły (I). Mając B i I możemy wyznaczyć odległość między molekułami (długość wiązania)
Ograniczenia w wyznaczaniu geometrycznym:
Badanie możliwe tylko w gazach (w fazie skondensowanej ruch rotacyjny jest ograniczony).
Badanie możliwe tylko dla molekuł o trwałym momencie dipolowym.
Skomplikowane widma rotacyjne dla molekuł wieloatomowych, molekuł asymetrycznych.
Spektroskopia rotacyjna
Zastosowanie:
Wyznaczenie geometrycznej struktury molekuły
Wyznaczenie momentu dipolowego molekuły (zwłaszcza dla rozszczepienia zdegenerowanych poziomów w polu elektrycznym - efekt Starka )
25. Spektroskopia w podczerwieni. Badania strukturalne
Spektroskopia oscylacyjna
Informacje z widm oscylacyjnych:
O częstotliwości i odległości miedzy poziomami energetycznymi
Stałe siłowe siła oddziaływań rodzaj wiązań (właściwości)
Amplituda: x = A ,
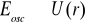
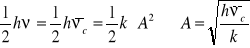
Długość wiązania: x0 = z
Energia poziomu „0” => energia potencjalna
Przykłady oscylacji:
podczas drgań nie może następować przemieszczenie środka masy molekuły jako całości
Rodzaje drgań normalnych:
W przypadku drgań normalnych występują zmiany długości wiązań (rozciąganie walencyjne) i kątów walencyjnych (zginanie deformujące)
Wyróżniamy drgania w płaszczyznach i poza nimi:
Konsekwencje:
Zmniejszenie długości wiązania przy
,
,
Molekuła wykonuje 3n-6 drgań własnych
Nie ma translacji i ruchu obrotowego
3n-6 drgań rozkłada się na składowe, każda o innej częstotliwości (rejestruje je spektroskop)
Jednoczesny ruch zrębów atomowych (wszystkich tej samej częstotliwości i o jednakowej fazie).
W czasie oscylacji zmienia się moment dipolowy.
Badania strukturalne:
Dostarcza informacji o:
Strukturze molekuł
Siłach wiązań
Oddziaływaniach między atomami
Rozkładzie gęstości elektronowej w molekułach
Polaryzowalności poszczególnych wiązań
Dzięki niej można przewidzieć przebieg reakcji fizykochemicznych.
26. Molekuła jako oscylator harmoniczny
Zachowanie molekuły zależy od wiązań jakie w niej występują.
Klasycznie
Model oscylatora harmonicznego opiera się na klasycznym prawie Hooke'a:
![]()
k - stała siłowa związana z typem wiązania
![]()
gdzie x0 jest położeniem równowagi
![]()
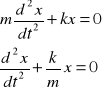
Rozwiązanie: ![]()
![]()
, ![]()
Kwantowo
![]()
=> ![]()
![]()
lub ![]()
Energia w przypadku oscylatora harmonicznego jest wielkością skwantowaną
(nie zmienia się ciągle tylko jak n)
W stanie podstawowym nosc = 0 a
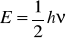
(energia nigdy nie jest zerowa ponieważ elektrony nigdy nie przestają oscylować)
Odległość pomiędzy poziomami energetycznymi:
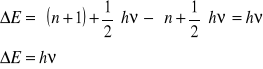
Rozkład prawdopodobieństwa:
Klasycznie: na granicach studni potencjału równa się zeru
Kwantowo: im wyższy poziom oscylacyjny n tym bardziej zbliżamy się do modelu klasycznego.
27. Oscylator anharmoniczny. Krzywa Morse'a.
Oscylator anharmoniczny
Równanie Schröedingera:
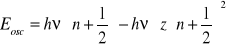
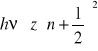
- energia związana z anharmonicznością
z - współczynnik anharmoniczności (odstępstwo od prawa Hooke'a)
Odległość między poziomami:
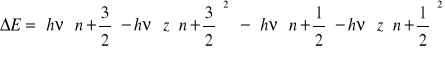
![]()
gdy z = 0 to ![]()
Konsekwencje:
Odległości pomiędzy poziomami nie są stałe, lecz zbliżają się do siebie.
Różnice częstotliwości ν symbol. ν 0 drgania na poziomie 0.
Stała siłowa k różna na różnych poziomach oscylacyjnych
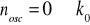
Rozszerzenie reguły wyboru
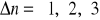
(łagodniejsza) wzrasta prawdopodobieństwo przejść (maleje wraz ze wzrostem n)
![]()
- najbardziej prawdopodobna
Przejścia:
0 1 ton podstawowy
1 2 pierwszy nadton
2 3 drugi nadton
Krzywa Morse'a
Jest to krzywa energii potencjalnej dla układu kwantowego. W rzeczywistości molekuły nie spełniają prawa Hooke'a (![]()
)
Oscylacje molekuły = oscylacje anharmoniczne
![]()
![]()
- stopień krzywizny krzywej (rozwarcie gałęzi)
Oscylator anharmoniczny: gdy
Oscylacje harmoniczne i anharmoniczne:
W pobliżu minimum oscylator harmoniczny zbliżony jest do enharmonicznego (dla niskich poziomów energetycznych mają te same właściwości).
Duże rozbieżności dla dużych nosc (wysokie stany oscylacyjne).
W praktyce w spektroskopii oscylacyjnej obsadzone są niskie stany oscylacyjne.
W oscylatorze anharmonicznym odległość pomiędzy poziomami maleje.
28. Widma oscylacyjne. Tony podstawowe i nadtony
Tony podstawowe i nadtony
Najbardziej intensywne są tony podstawowe.
Gdy na układ działa promieniowanie elektromagnetyczne to zostają wymuszone przejścia.
W ~ g (gęstość promieniowania liczba fotonów/objętość)
![]()
![]()
- współczynnik absorpcji Einsteina
gdzie ![]()
> 0 prawdopodobieństwo absorpcji musi być większe od zera aby promieniowanie zostało pochłonięte
Równanie Schröedingera:
![]()
![]()
- moment przejścia między stanem „n” (podstawowym) a „w” (wzbudzonym)
(*) ![]()
![]()
- operator momentu dipolowego (1 debaj - jednostka)
Wniosek:
Jeśli moment przejścia jest równy zeru to nie ma przejść więc absorpcja nie zachodzi.
Szereg Macklaurina:
Aby rozwiązać równanie (*) rozwijamy równanie w szereg Macklaurina:
![]()
Przejście 0 1
![]()
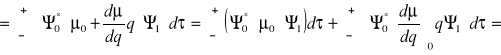
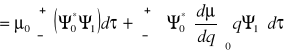
![]()
- część związana ze stałym momentem dipolowym (![]()
nie zależy od q)
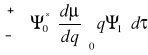
- część związana ze zmianą momentu dipolowego
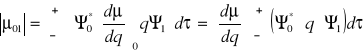
![]()
i ![]()
wynikają z równania Schröedingera
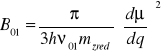
Wniosek:
Prawdopodobieństwo tonów podstawowych ~
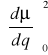
(kwadrat zmian momentu dipolowego)Jeśli nie ma zmian momentu dipolowego w czasie drgania
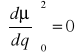
(promieniowanie nie jest absorbowane - drgania nieaktywne)
29. Prawo Lamberta - Beera. Współczynnik Einsteina absorpcji
Prawo Lamberta - Beera
Głosi, że zależność między wielkością absorpcji (ekstynkcji) A światła pochłanianego przez roztwór o stężeniu substancji absorbującej c stanowiący warstwę o grubości l dana jest wyrażeniem:
![]()
gdzie:
ε oznacza molowy współczynnik absorpcji, charakterystyczny dla danej substancji przy danej długości fali absorbowanego światła.
Zależność ta ma charakter przybliżony lecz w niewielkich zakresach stężeń pozwala wyznaczać stężenia substancji rozpuszczonej na podstawie pomiaru wielkości absorpcji roztworu
Prawo Lamberta-Beera jest wynikiem połączenia dwóch prostszych praw optyki
Prawo Lamberta
Mówi, że wielkość absorbancji światła ABS jest wprost proporcjonalna do grubości ośrodka l przez które to promieniowanie przechodzi.
![]()
Prawo Beera
Mówi, że wielkość absorbancji światła ABS w ośrodku jest wprost proporcjonalna do stężenia c substancji pochłaniającej światło.
![]()
Zanik natężenia na drodze l:
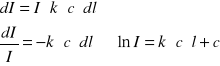
Z warunków brzegowych:
l = 0
I = I0
ln(I0) = C
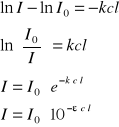
![]()
- absorbancja
![]()
- transmitancja
Prawo słuszne, gdy natężenie roztworu badanej molekuły jest odpowiednio małe.
31. Prawdopodobieństwo procesu absorpcji i emisji
![]()
- prawdopodobieństwo absorpcji wymuszonej
![]()
- prawdopodobieństwo emisji spontanicznej
![]()
- prawdopodobieństwo emisji wymuszonej
![]()
- gęstość promieniowania
![]()
- liczba przejść absorpcyjnych
![]()
- liczba przejść emisji spontanicznej
![]()
- liczba przejść emisji wymuszonej
![]()
- liczba molekuł na poziomie niższym „n”
![]()
- liczba molekuł na poziomie wyższym „w”
Absorpcji
![]()
Emisji
Spontanicznej
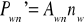
Wymuszonej
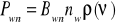
32. Emisja spontaniczna i wmuszona
Emisja spontaniczna
Zachodzi wtedy, gdy elektrony znajdujące się na poziomach wzbudzonych w sposób spontaniczny wracają na niższe poziomy energetyczne, emitując przy tym fotony.
Zjawisko występuje powszechnie i odpowiada za niemal każde świecenie ciał, np. gazów rozgrzanych, wzbudzonych atomów, ciał ciekłych i stałych, a także urządzeń elektronicznych diodę elektroluminescencyjną (LED).
Diagram przedstawiający emisję spontaniczną:
Emisja wymuszona (indukowana)
Jest to proces emisji fotonów przez materię w wyniku oddziaływania z innym fotonem. Foton inicjujący emisję nie jest pochłaniany przez materię, wytwarzany foton ma fazę i częstotliwość taką samą jak foton oryginalny. Zjawisko to odgrywa ważną rolę w emisji fotonów przez ciała a szczególne znaczenia odgrywa w laserach, będąc podstawą ich działania
Zjawisko to zostało przewidziane przez Alberta Einsteina, który zauważył, że bez tego zjawiska nie mogłoby dojść do równowagi między pochłanianiem i emisją ciała oświetlonego przez inne ciało.
Einstein rozumował: jeżeli oddziaływanie atomu z fotonem wywołuje pochłonięcie fotonu z prawdopodobieństwem zależnym od ilości fotonów o odpowiedniej energii (natężeniu oświetlania), zaś emisja występuje czysto swobodnie, z prawdopodobieństwem zależnym wyłącznie od wielkości charakteryzujących wzbudzony poziom energetyczny, to atom wzbudzony musi emitować foton w wyniku oddziaływania z fotonem, z prawdopodobieństwem zależnym od ilości odpowiednich fotonów, by mogło dojść do równowagi termodynamicznej między pochłanianiem i emitowaniem fotonów
Emisja wymuszona jest zjawiskiem odwrotnym do pochłaniania fotonów przez atomy (cząsteczki). Prawdopodobieństwo pochłonięcia fotonu przez atom w stanie o mniejszej energii jest takie samo jak prawdopodobieństwo emisji wymuszonej atomu wzbudzonego, dlatego o wielkości emisji/pochłaniania ośrodka decyduje różnica liczby atomów w stanie wzbudzonym i podstawowym.
Schematyczne przedstawienie emisji wymuszonej.
Stan równowagi obsadzeń:
Szybkość przejść z poziomu niższego na wyższy jest równa szybkości przejść z poziomu wyższego na niższy:
![]()
![]()
![]()
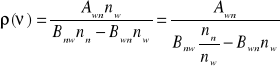
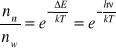
![]()
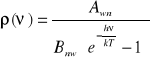
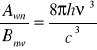
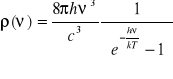
![]()
- współczynnik Einsteina Absorpcji
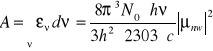
- absorpcja
![]()
![]()
- elektronowy moment przejścia
![]()
- stopień w jakim przejście jest dozwolone
(ma wielkość obserwowanego współczynnika absorpcji)
34. Zasada Francka - Condona
Stwierdza, że w trakcie przejścia elektronowego jądra atomowe w cząsteczce nie zmieniają w praktyce ani swych położeń ani swych prędkości. Oznacza to, że spośród wszystkich możliwych przejść elektronowo - oscylacyjnych pomiędzy dwoma stanami elektronowymi najbardziej prawdopodobne są też przejścia, w wyniku których nie zmienia się położenie lub konfiguracja jąder, ani ich moment pędu.
Poza tym przejścia elektronowe w molekule odbywają się bardzo szybko porównaniu z oscylacyjnym ruchem jąder, że wszystkie odległości międzyjądrowe można uznać za stałe w czasie przejścia elektronowego.
Występują trzy przypadki:
kiedy odległość równowagi w stanie wzbudzonym jest taka sama, jak odległość równowagi w stanie podstawowym
kiedy odległość równowagi w stanie wzbudzonym jest większa niż odległość równowagi w stanie podstawowym
odległość równowagi w stanie wzbudzonym jest mniejsza niż odległość równowagi w stanie podstawowym
W myśl zasady Francka - Condona, przy przejściu elektronowym do wyższego stanu zarówno odległość międzyjądrową, jak też i prędkość ruchu jąder nie powinna ulegać wyraźnym zmianom, wobec tego możliwe są przejścia.
Zasada Francka-Condona ma nie tylko duże znaczenie dla zrozumienia postaci obserwowanego widma i powiązania tej postaci ze zmianami podstawowych parametrów cząsteczki, ale jest również ważna dla zrozumienia wielu innych procesów, w których udział biorą wzbudzone stany elektronowo-oscylacyjne
35. Dezaktywacja stanów wzbudzonych
Po zaabsorbowaniu energii molekuły dążą do jej oddania i powrotu do stanu równowagi termicznej określonej wzorem:
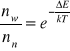
Mechanizmy pozbywania się nadmiaru energii :
Bezpromienisty
Promienisty
Energia oscylacyjna i rotacyjna oddawane są w sposób bezpromienisty w zderzeniach ponieważ średnia energia:
wymieniana w zderzeniach wywołanych ruchem translacyjnym i rotacyjnym molekuł jest zbliżona do odstępów poziomów oscylacyjnych i rotacyjnych.
Energia wzbudzenia elektronowego jest zbyt duża aby molekuła mogła się jej pozbyć bezpromieniście w zakresie niewysokich temperatur. Dominuje w tym przypadku proces promienisty i molekuła po pewnym czasie emituje pochłonięty foton. To zjawisko nazywamy luminescencją.
Jeżeli wzbudzenie elektronowe następuje w skutek podgrzania do wysokiej temperatury to następuje po nim promienista emisja energii zwana Termoluminescencją.
Wywołanie zbudzenia elektronowego pod wpływem tarcia lub kruszenia ciał stałych powoduje emisję promieniowania zwiana Tryboluminescencją.
Gdy energia jest zbyt duża wtedy dezaktywacja jest niemożliwa (dominacja procesów promienistych)
Fluorescencja:
proces dezaktywacji stanu wzbudzonego zachodzącego po wzbudzeniu elektronowym - absorpcja promieniowanie elektromagnetycznego. Jest charakterystyczna dla molekuł sztywnych, nie zależy od długości fali światła wzbudzającego ją. Jest związana z najniższym stanem wzbudzonym, niezależnie z jakiego stanu molekuła została wzbudzona.
Ważnym czynnikiem warunkującym dezaktywację jest różnica poziomów energetycznych.
36. Procesy promieniste i bezpromieniste. Schemat Jabłońskiego.
Procesy promieniste i bezpromieniste
Do procesów promienistych zaliczamy fluorescencję
Do procesów bezpromienistych zaliczamy luminescencję
Procesy bezpromieniste są o wiele szybsze od promienistych
Przejście bezpromieniste (konwersja wewnętrzna) jest mniej wydajne i dużo wolniejsze. Nie zmienia się w tym przypadku krotność. Procesy z wyższych stanów do niższych są bardzo szybkie.
Szybkość procesów bezpromienistych:
![]()
![]()
![]()
![]()
Procesy promieniste:
konwersja wewnętrzna
przejścia międzysystemowe
fluorescencja
fosforencja
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
Schemat Jabłońskiego
czas życia Fosforencja jest znacznie dłuższy niż Fluorescencji
37. Emisja spontaniczna. Reguła Kashy. Reguła Stockesa.
Reguła Stockesa
Długości fali promieniowania fluorescencyjnego są większe od długości fali promieniowania wzbudzającego fluorescencję lub co najwyżej im równe.
40. Parametry charakteryzujące fluorescencję
Widmo fluorescencji
Im więcej zaabsorbowano tym więcej wyemituje, ale tylko wtedy gdy natężenie światła nie jest duże (bo wtedy mamy do czynienia z efektem dwufotonowym)
![]()
Wydajność kwantowa fluorescencji
![]()
- słabo i silnie świecące molekuły
![]()
![]()
- ilość kwantów wyemitowanych; ![]()
- ilość kwantów zaabsorbowanych
![]()
dla ![]()
![]()
- gęstość optyczna (mała wartość absorbancji)
![]()
- natężenie padającego światła
![]()
- współczynnik ekstynkcji (zależy od dł. fali ilość rodzaju materii)
![]()
- ilość molekuł
![]()
- długość drogi
![]()
![]()
czyli ![]()
![]()
suma wszystkich wydajności procesów (wynika z ZZE)
![]()
odzwierciedla wydajność innych procesów
Żadna molekuła nie świeci ze 100% wydajnością
![]()
Im ![]()
jest mniejsza od 1 to inne procesy mają większy wpływ na dezaktywację fluorescencji
Czas życia fluorescencji
Jest to czas przebywania molekuły w stanie wzbudzonym
(zależy od momentu przejścia - czas zaniku fluorescencji)
![]()
Po czasie ![]()
molekuła przechodzi do stanu podstawowego emitując promieniowanie.
![]()
![]()
molekuła w stanie podstawowym
![]()
molekuła w stanie wzbudzonym
![]()
wyemitowane promieniowanie
![]()
Każda molekuła ma swój czas życia (nie jesteśmy w stanie dokładnie go określić)
Mamy tu do czynienia z zasadą nieoznaczoności Heisenberga:
![]()
w stanie podstawowym ![]()
jest ściśle określone bo ![]()
w tym stanie jest bardzo długie.
Średni czas życia zbiorowiska molekuł (doświadczalny lub teoretyczny) - bo każda molekułami inny czas życia fluorescencji.
Oszacowanie czasu życia:
Zał.
Molekuła w stanie wzbudzonym (przejście promieniste jest jedyna drogą dezaktywacji)
![]()
molekuła w czasie ![]()
jest w stanie wzbudzonym ![]()
![]()
molekuła po czasie t wyrzuca promieniowanie
![]()
molekuły które przeszły do stanu podstawowego w czasie dt
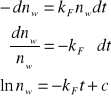
obliczamy stałą „c” z warunków początkowych t0 i n0
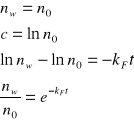
![]()
- naturalny czas życia (gdy nieobecne są inne procesy dezaktywacyjne)
![]()
ilość procesów zachodzących w 1 sekundę
![]()
współczynnik Einsteina emisji
stąd: ![]()
(*)
czas życia molekuły możemy wyznaczyć znając absorbancję
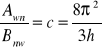
(**)
z (*) i (**) ![]()
Po czasie ![]()
zanika do 66% wzbudzonych molekuł.
![]()
; ![]()
![]()
![]()
- początkowe natężenie fluorescencji w czasie ![]()
![]()
- natężenie fluorescencji po czasie t
Gdy emitowana fluorescencja jest jedynym procesem dezaktywacyjnym to zanik fluorescencji jest równy naturalnemu czasowi życia stanu wzbudzonego.
Rzeczywisty czas życia jest zawsze inny od czasu naturalnego
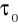
bo oprócz zaniku stanu wzbudzonego na drodze fluorescencji zachodzą procesy bezpromieniste.
![]()
![]()
- stała szybkości procesów zachodzących w molekule
![]()
- stała szybkości procesów promienistych
![]()
- stała szybkości procesów bezpromienistych
![]()
![]()
![]()
(realna sytuacja)
Procesy niepromieniste skracają czas życia fluorescencji
Każdemu kwantowi zaabsorbowanego promieniowania odpowiada kwant promieniowania wyemitowanego.
![]()
![]()
![]()
- naturalny czas życia
![]()
- rzeczywisty czas życia
Im bardziej prawdopodobne przejście absorpcyjne (większe natężenie absorpcji) tym krótszy czas życia stanu wzbudzonego.
Przy założeniach krzywej Gaussa:
![]()
![]()
- średnia częstość pasma absorpcji
![]()
- szerokość połówkowa pasma absorpcji
![]()
- współczynnik molowy absorpcji w maksimum absorpcji
Polaryzacja fluorescencji
Aby molekuła świeciła musi być sztywna.
51
Opracowała: Joanna Bartusik
1 z 53
Wyszukiwarka
Podobne podstrony:
Egzamin z fizyki Elektrotechnika sem I 2013 2014
Pytania do egzaminu z fizyki sem.1 teoria
Zagadnienia na egzamin z fizyki Elektrotechnika sem I - 2012-2013, Politechnika Poznańska, Elektrote
Egzamin z fizyki Elektrotechnika sem I pdf (1)
Pytania z fizyki na egzamin, Budownictwo PG, Sem II, Fizyka, Egzamin
Pytania egzaminacyjne z fizyki sem II, Studia, Sem 2, SEMESTR II, SEMESTR I, fizyka, haksy, Fiza
Egzamin z fizyki Elektrotechnika sem I , Polibuda, I semestr, fizyka
molekuły, egzamin - stare pytania
test z fizyki, Energetyka AGH, semestr 6, VI Semestr, Energia Jądrowa, EGZAMIN, EJ
15 przykladowy egzamin z fizyki
opracowanie egzamin fizyki v1 0
Genetyka ogólna - pytania na egzamin, Genetyka, DNA, biologia molekularna, techniki
Zagadnienia egzaminacyjne PF3-09, SKRYPTY, NOTATKI, WYKŁADY, Podstawy Fizyki 3, wykład
EGZAMIN Z FIZYKI
Opracowanie na egzamin z fizyki, semestr I(1)
gotowe z fizyki na egzamin!!
test egzaminacyjny z fizyki 2
więcej podobnych podstron