I Wprowadzenie
POTENCJOMETRIA - należy do metod elektroanalitycznych, które obejmują szereg technik pomiarowych, opartych na badaniu reakcji elektrodowych i procesów zachodzących między elektrodami. Podstawę metod elektroanalitycznych stanowi pomiar wielkości elektrycznych (napięcie, natężenie prądu, opór elektryczny) związanych ze stężeniem bądź całkowitą ilością oznaczonej substancji.
METODY POTENCJOMETRYCZNE - polegają na pomiarze siły elektromotorycznej (SEM) ogniwa złożonego z dwóch elektrod zanurzonych w badanym roztworze. Mierzona SEM zależy w określony sposób od stężenia składnika oznaczonego w roztworze. Podstawą pomiarów jest równanie Nernsta. Zwykle odpowiedzialną za zmiany SEM jest jedna z elektrod zwana wskaźnikową, której potencjał zależy od stężenia oznaczonego jonu. Rozróżniamy potencjometrię bezpośrednią oraz miareczkowanie potencjometryczne.
POTENCJOMETRIA BEZPOŚREDNIA - oznaczenie stężenia interesującego nas składnika przez pomiar SEM ogniwa z odpowiednią elektrodą wskaźnikową np. pomiar pH za pomocą elektrod jonoselektywnych.
MIARECZKOWANIE POTENCJOMETRYCZNE - w którym wielkością mierzoną są zmiany siły elektromotorycznej ogniwa w czasie miareczkowania alkacymetrycznego, redoks lub strąceniowego.
Cel ćwiczenia
Celem ćwiczenia jest oznaczenie Fe2+ zawartego w roztworze otrzymanym do analizy Oznaczanie zasadowości wody metodą miareczkowania potencjometrycznego polega na określeniu zasadowości związków reagujących zasadowo wobec fenoloftaleiny i oranżu metylowego Zawartości tych związków jest równoważna ilości miligramorównoważników (moli) kwasu mineralnego, zużytego do miareczkowania próby w obecności odpowiedniego wskaźnika lub dokładniej do określenia wartości pH.
Celem ćwiczenia jest oznaczenie stężenia jonów fluorkowych w roztworze za pomocą jonoselektywnej elektrody fluorkowej .
3.Wykonanie ćwiczenia
Przygotowujemy analizowany roztwór do miareczkowania W tym celu umieszczamy badany roztwór w zlewce o pojemności 250 cm3 i uzupełnić do 100 cm3 roztworem HCl o stężeniu 2,0 mol/dm3
Przygotowany roztwór umieszczamy na mieszadle magnetycznym podgrzewamy do temperatury 45oC i zanurzamy w nim połączone z potencjometrem elektrody platynową i srebrową.
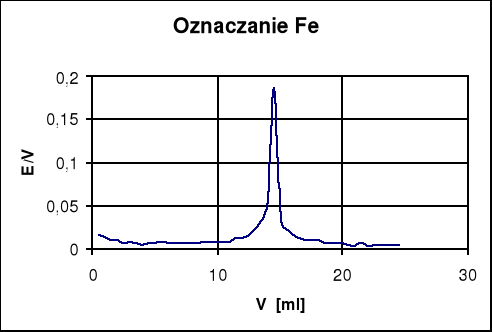
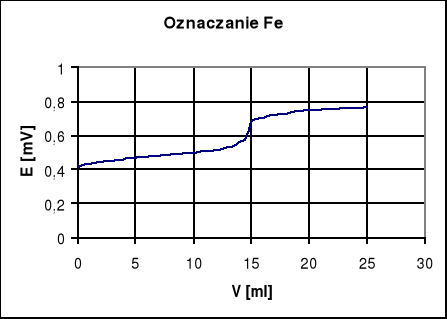
Podgrzany roztwór miareczkujemy potencjometrycznie roztworem K 2Cr 2O7 o stężeniu 0,01 mol/dm3 dodając porcjami po 0,5 cm3 Notujemy w tabelce sumaryczną liczbę centymetrów sześciennych roztworu miareczkującego i odpowiadającą jej wartość SEM ogniwa pomiarowego Podstawą do oznaczania jest reakcja redoks, przebiegająca w środowisku kwaśnym według schematu;
Cr2O72+ + 6Fe2+ + 14H+ 2Cr3+ + 6Fe3+ + 7H2O
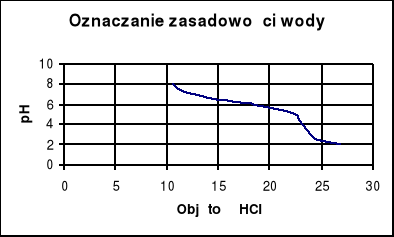
b) Do zlewki o pojemności 200 cm3 ustawionej na mieszadle magnetycznym , odmierzamy 100 cm3 badanej wody i miareczkujemy roztworem kwasu solnego aż do osiągnięcia pH od 8,5 do 8,0 oraz 4,8 do 4,2 dodawać małe porcje roztworu kwasu.
c) Przygotowujemy roztwory wzorcowe NaF o stężeniu 10-1 10-2 10-3 10-4 10-5 10-6 10-7 mol/dm3 Do kolbki miarowej na 50 cm3 odmierzamy 5 cm3 roztworu NaF i 25 cm3 buforu TISAB. Rozcieńczamy do kreski wodą destylowaną Następne roztwory otrzymujemy przez dziesięciokrotne rozcięczania dodając każdorazowo 25 cm3 buforu.
Mierzymy SEM ogniwa pomiarowego w przygotowanych roztworach w czasie mieszania
Przygotowujemy próbki otrzymane do analizy poprzez dodanie 25 cm3 roztworu TISAB oraz uzupełniamy wodą do 50 cm3.
Mierzymy SEM ogniwa pomiarowego w analizowanych próbkach.
Wykonanie obliczeń
Zawartość Fe2+ w analizowanym roztworze obliczamy na podstawie stechiometrii w równaniu reakcji:
Cr2O72- + 6Fe2+ + 14H+ 2Cr3+ 6Fe3+ 7H2O
2Cr6+ + 6e- 2Cr3+ 6
Fe2+ - 1e Fe3+ 1
-2+12+x=6+18
x=14
1mol K2Cr2O7 reaguje z 6 molami Fe2+
1000cm3 K2Cr2O7 --- 0,01 mol K2Cr2O7
15,2 cm3 K2Cr2O7 --- x moli K2Cr2O7
x=1,52*10-4 mol K2Cr2O7
1mol K2Cr2O7 --- 6 moli Fe2+
1,52*10-4 mol K2Cr2O7 --- x moli Fe2+
x= 9,12*10-4 mola Fe2+
1 mol Fe2+ --- 55847 mg
9,12*10-4 mola Fe2+ --- x mg
x=50,93 mg Fe2+
C)
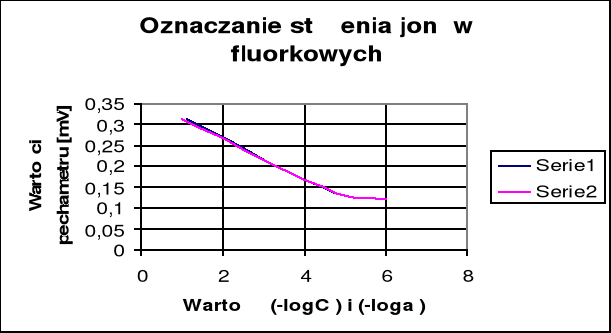
-log CF
-log 10-1 = 1 aF=10-1*0,74=7,4*10-2 -log 7,4*10-2=1,13
-log 10-2 = 2 aF=10-2*0,89=8,9*10-3 -log 8,9*10-3=2,05
-log 10-3 = 3 aF=10-3*0,95=9,5*10-4 -log 9,5*10-4=3,02
-log 10-4 = 4 aF=10-4*0,98=9,8*10-5 -log 9,8*10-5=4,01
-log 10-5 = 5 aF=10-5*0,99=9,9*10-6 -log 9,9*10-6=5,01
-log 10-6 = 6 aF=10-6*1,0=1*10-6 -log 1*10-6 = 6,00
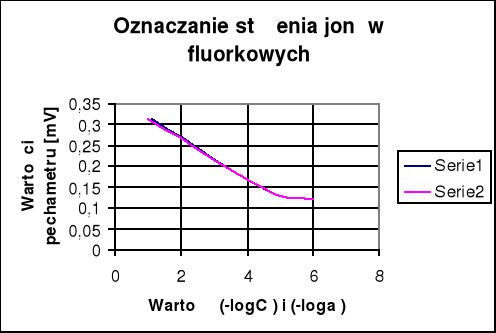
Z wykresu E=f(-log CF) odczytuję (-log CF), a następnie obliczam CF
-logCF = 1,4
CF = 10-1,4 = 0,03981 [mol/dm3]
Z wykresu odczytuję że zakres pomiarowy czyli zakres prostoliniowy zależności mieści się w przedziale od 1 do 4,5 (-log CF )
B)
Vm. = 22,9 [cm3]
Vp - nie można odczytać z wykresu gdyż wykonane miareczkowanie nie obejmuje zakresu pH =8,3
Zm.= Vm.*100/V=22,9*100/100=22,9[mval/dm3]
Zm.= 2,8*Vm.*100/100=64,12[stopni]
Ponieważ nie możemy odczytać z wykresu wartości Vp nie możemy również obliczyć zasadowości Zp , ZOH_ , ZHCO_ , ZCO2
Ćwiczenie zostało źle wykonane z powodu dodania zbyt dużej ilości HCl na początku miareczkowania co spowodowało uzyskanie pierwszego wyniku wartości pH na pehametrze niższego niż 8,3.
PK
Wyszukiwarka
Podobne podstrony:
Dziennik niwelacji terenowej sposobem punktow rozproszonych sala(1)(1)
Niwelacja metodą punktów rozproszonych2
Dziennik niwelacji powierzchniowej sposobem punktów rozproszonych
Dziennik niwelacji powierzchniowej sposobem punktów rozproszonych
Dziennik Niwelacji Punktów Rozproszonych, Praktyka zawodowa, dzienniki
Dziennik niwelacji punktów rozproszonych
~$Dziennik niwelacji punktów rozproszonych
dziennik niwelacji punktów rozproszonych Poprawiony
woźniak, geodezja inżynierska, niwelacja punktów rozproszonych
Metoda punktów wierzcholkowych
7.Wyrównywanie sieci poligonowej z trzema punktami węzłowymi metodą przybliżoną, dziennik Obliczanie
badania metoda punktowa
druki, Obliczanie sieci poligonowych metodą punktów węzłowych
Wykłady z BHP, Obliczanie oświetlenia metodą punktową, Obliczanie oświetlenia metodą punktową
więcej podobnych podstron