Badanie kinetyki katalitycznego rozkładu H2O2. |
Odczynniki: mianowany roztwór KMnO4, 0.01 i 0.02 M Fe2(SO4)3, 1 % H2O2, 2 M H2SO4.
Szkło: biurety, kolby stożkowe, pipety skalowane, gruszki gumowe, dozowniki.
Materiał teoretyczny: podstawowe pojęcia kinetyki chemicznej (szybkość reakcji, rząd, stała szybkości), czynniki wpływające na szybkość reakcji chemicznych. Manganometryczne oznaczanie nadtlenku wodoru.
Wprowadzenie
1. Reakcje pierwszego rzędu.
Reakcję pierwszego rzędu można przedstawić równaniem: A → B.
Szybkość tej reakcji jest proporcjonalna do pierwszej potęgi chwilowego stężenia cA substratu A:
v = k cA
Mierząc szybkość reakcji jako ubytek stężenia substratu A w funkcji czasu, otrzymujemy równanie kinetyczne w postaci różniczkowej:
![]()
Rozdzielając zmienne i całkując obustronnie powyższe równanie otrzymujemy:
ln ![]()
Stałą całkowania wyznaczamy z warunków początkowych: dla t = 0, cA= a, stąd: ![]()
czyli: ![]()
przekształcając powyższe równanie otrzymujemy: ![]()
. Z równania tego otrzymujemy:
![]()
czyli: ![]()
stąd: ![]()
Z równań powyższych wynika, że dla reakcji pierwszego rzędu:
- stężenie substratu maleje wykładniczo w funkcji czasu: cA= a e-kt
- zależność ![]()
w funkcji czasu t jest liniowa. Z nachylenia prostej względem osi czasu wyznacza się stałą szybkości k
- wymiarem stałej szybkości jest odwrotność jednostki czasu.
2. Rozkład nadtlenku wodoru zachodzi wg równania:
H2O2 → H2O + ½ O2↑
W zwykłej temperaturze i bez katalizatora samorzutny rozkład zachodzi bardzo wolno. Reakcję tę katalizuje wiele substancji, w tym jony metali, a także promieniowanie UV. W zależności od rodzaju katalizatora powstają różne produkty przejściowe w etapach pośrednich i ogólny rząd reakcji może mieć różne wartości. W przypadku katalizy jonami Fe3+ kinetyka odpowiada reakcji pierwszego rzędu. Postęp reakcji rozkładu H2O2 można śledzić w oparciu o ubytek substratu, tzn. H2O2.
Cel ćwiczenia: potwierdzenie rzędowości reakcji katalitycznego rozkładu H2O2 w obecności Fe3+, określenie wpływu katalizatora na szybkość reakcji oraz wyznaczenie stałych szybkości reakcji.
Wykonanie
1. Przygotowanie mieszanin reakcyjnych i pobieranie próbek.
Do trzech ponumerowanych kolb stożkowych wprowadzić po 75 cm3 1% roztworu nadtlenku wodoru, a następnie odpowiednio:
kolba 1 - 5 cm3 wody destylowanej [0 M Fe2(SO4)3 ]
kolba 2 - 5 cm3 0.01 M Fe2(SO4)3
kolba 3 - 5 cm3 0.02 M Fe2(SO4)3,
Czas dodania katalizatora Fe2(SO4)3 uważamy za czas rozpoczęcia reakcji rozkładu nadtlenku wodoru. Pobrać próbki o objętości po 5 cm3 odpowiednio:
kolba 1 - 3 próbki co 30 min (t = 0, t = 30 min, t = 60 min).
kolby 2 i 3 - po 5 próbek co 15 min (t = 15 min, t = 30 min, t = 45 min, t = 60 min).
Próbka pobrana z kolby 1 (bez katalizatora) dla t = 0, odpowiada próbkom dla t = 0, z katalizatorem. Próbki wprowadzać do kolb zawierających po 10 cm3 2 M H2SO4. We wszystkich przypadkach za czas pobrania próbki przyjmujemy moment wprowadzenia próbki do roztworu H2SO4 (w silnie kwaśnym środowisku rozkład nadtlenku wodoru zostaje zahamowany). Ilość nierozłożonego H2O2 oznaczać miareczkując mianowanym roztworem KMnO4.
2. Manganometryczne oznaczanie H2O2.
Nadtlenek wodoru w stosunku do silnych utleniaczy (np. MnO4-, PbO2, MnO2) zachowuje się w środowisku kwaśnym jak reduktor. Reakcję nadtlenku wodoru z manganianem(VII) potasu przedstawia równanie:
2MnO4- + 5H2O2.+ 6H+ → 2Mn2+ + 5O2↑ + 8H2O
Aby reakcja przebiegła dość szybko musi być znaczne stężenie kwasu siarkowego w miareczkowanym roztworze.
Pobraną próbkę roztworu H2O2 o objętości 5 cm3 wprowadzić do kolby stożkowej zawierającej 10 cm3 2 M H2SO4 i miareczkować mianowanym roztworem KMnO4 o stężeniu C, do trwałego, lekko różowego zabarwienia.
Zawartość H2O2 (w mol/dm3) obliczyć wg wzoru:
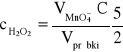
3. Opracowanie wyników.
a) Obliczyć stężenie H2O2 w poszczególnych próbkach.
Stężenie H2O2 w próbce bez katalizatora dla t = 0 odpowiada początkowemu stężeniu H2O2 (cA = a).
b) Sporządzić wykresy zależności stężenia H2O2 od czasu reakcji dla mieszanin reakcyjnych 1,2,3.
c) Sporządzić wykresy zależności ln cH2O2 od czasu reakcji dla mieszanin reakcyjnych 1,2,3, wykreślić proste i wyznaczyć ich nachylenia (k).
d) Przedyskutować otrzymane wartości stałych szybkości k w badanych układach.
Nr |
Katalizator Fe2(SO4)3 |
Czas reakcji [min] |
Objętość KMnO4 [cm3] |
Stężenie H2O2 [mol/dm3] |
ln (a/cH2O2) |
k [min-1] |
1 |
- |
0 |
|
a = |
|
|
|
|
30 |
|
|
|
|
|
|
60 |
|
|
|
|
2 |
0.01 M |
0 |
|
|
|
|
|
|
15 |
|
|
|
|
|
|
30 |
|
|
|
|
|
|
45 |
|
|
|
|
|
|
60 |
|
|
|
|
3 |
0.02 M |
0 |
|
|
|
|
|
|
15 |
|
|
|
|
|
|
30 |
|
|
|
|
|
|
45 |
|
|
|
|
|
|
60 |
|
|
|
|
Literatura
Krzysztof Pigoń, Zdzisław Ruziewicz „Chemia fizyczna” PWN Wwa
Peter Wiliam Atkins „Podstawy chemii fizycznej” PWN
2
Wyszukiwarka
Podobne podstrony:
Konwersatorium III, BIOLOGIA UJ LATA I-III, ROK I, semestr I, chemia nieorganiczna i ogólna
Botanika program, BIOLOGIA UJ LATA I-III, ROK I, semestr II, botanika systematyczna
cwiczenia 1 instrukcja 2010, BIOLOGIA UJ LATA I-III, ROK III, semestr I, Mikrobiologia, Cwiczenia
cwiczenia 9 i 10 instrukcja 2010, BIOLOGIA UJ LATA I-III, ROK III, semestr I, Mikrobiologia, Cwiczen
cwiczenia 8 instrukcja 2010, BIOLOGIA UJ LATA I-III, ROK III, semestr I, Mikrobiologia, Cwiczenia
cwiczenia 7B instrukcja 2010, BIOLOGIA UJ LATA I-III, ROK III, semestr I, Mikrobiologia, Cwiczenia
cwiczenia 1 instrukcja 2010, BIOLOGIA UJ LATA I-III, ROK III, semestr I, Mikrobiologia, Cwiczenia
6 Bioakustyka, BIOLOGIA UJ LATA I-III, ROK III, semestr I, biofizyka, sprawozdania
kontrola cyklu komorkowego i smierc komorki, BIOLOGIA UJ LATA I-III, ROK II, semestr I, biologia kom
hand-out agresja, BIOLOGIA UJ LATA I-III, ROK III, dydaktyka, psychologia, Nowy folder
Sprawozdanie efekt fotodynamiczny, BIOLOGIA UJ LATA I-III, ROK III, semestr I, biofizyka, sprawozdan
sprawko biooptyka, BIOLOGIA UJ LATA I-III, ROK III, semestr I, biofizyka, sprawozdania
Egzamin Ochrona Przyrody - Prof. Zając, BIOLOGIA UJ LATA I-III, ROK II, semestr II, Ochrona środowis
Pytania z egzaminu, BIOLOGIA UJ LATA I-III, ROK III, semestr I, biofizyka
fizjologia kolos 2, BIOLOGIA UJ LATA I-III, ROK III, semestr II, Fizjologia roślin
Egzamin z OWI, BIOLOGIA UJ LATA I-III, ROK III, semestr I, OWI
Wymagania na egzamin, BIOLOGIA UJ LATA I-III, ROK III, semestr I, ewolucjonizm, egzamin
Pogoda klimat cw 3, BIOLOGIA UJ LATA I-III, ROK III, semestr II, PNoZ
więcej podobnych podstron