Biotechnologia II
Laboratorium
Immobilizowane biokatalizatory
Data wykonania ćw: 16.03.2010
Data oddania sprawozdania: 23.03.2010
Data oddania zwrotu spr.: 30.03.2010
Wstęp teoretyczny:
Biokatalizator są to enzymy, kompleksy enzymów, organelle komórkowe, całe komórki lub ich różne kombinacje.
Immobilizacja enzymów lub komórek jest to zespół metod umożliwiających unieruchomienie enzymów lub całych komórek na stałym podłożu w wyniku ich adsorpcji, wiązania kowalencyjnego lub zamknięcia w kapsułkach z półprzepuszczalnych błon.
Metoda immobilizacji jest przykładem wielokrotnego stosowania biokatalizatorów w tym samym procesie technologicznym, w celu poprawy ich efektywności. Zastosowanie unieruchomionych biokatalizatorów powoduje zwiększenie wydajności procesów biologicznych. Spowodowane jest to zwiększeniem gęstości populacji komórek lub skoncentrowaniem aktywnych białek enzymatycznych, a także tym, że dzięki zastosowaniu bardzo prostych metod separacji, np. filtracji, można te biokatalizatory oddzielić od produktu i ponownie zastosować w tym samym celu.
Nośniki stosowane w immobilizacji bioproduktów:
Rozpuszczalne:
rozpuszczalny dekstran
glikol polioksyetylenowy
alkohol poliwinylowy
Nierozpuszczalne:
Organiczne:
Naturalne: alginian, żelatyna, agar, albumina, kolagen, dekstran, skrobia
Syntetyczne: silikony, poliuretan, polistyren
Nieorganiczne: ziemia okrzemkowa, krzemionka i jej formy np. szkło
Podstawowe sposoby unieruchamiania:
Metody fizyczne:
Adsorpcja na nierozpuszczalnych nośnikach. Podstawą jest proces adsorpcji, w którym ważne jest elektrostatyczne oddziaływanie między nośnikiem i komórką. Wydajność adsorpcji komórek zależy przede wszystkim od ich wieku (ładunek komórki zmienia się wraz z wiekiem) oraz pH środowiska. Nośnikami najczęściej stosowanymi w tej metodzie są szkło porowate, pochodne celulozy, żywice jonowymienne, wióry bukowe, dekstran, krzemionka itp. W metodzie tej nośnik stały jest kolonizowany przez komórki, powstaje błonka (film) na powierzchni nośnika. W przyłączaniu komórek do nośnika wykorzystuje się elektrostatyczne oddziaływanie między komórkami a ładunkiem dodatnim na powierzchni nośnika.
Pułapkowanie (inkluzja). Zamykanie komórek w matrycy polimeru. Najczęściej stosowane polimery: alginiany, agar, pektyna, żywice epoksydowe itp. Matrycę polimeru uzyskuje się przez żelowanie w łagodnych warunkach, co umożliwia zamknięcie komórek z minimalną stratą ich aktywności.
Mikrokapsułkowanie. Zamykanie enzymów lub komórek we wnętrzu kapsułki, która imituje naturalne błony biologiczne. Membrany te są półprzepuszczalne i łatwo przez nie dyfunduję małocząsteczkowe produkty i substraty. Komórki zazwyczaj zamyka się w żelach w postaci kulek, a następnie powleka je dodatkowo płaszczem ochronnym złożonym z polimeru, np. polietylenoiminy. Polimerowa bariera chroni zamknięte komórki przed przedostaniem się ich z wnętrza mikrokapsułki do produktu, przepuszczając tylko molekuły mniejsze niż 100 000 Da.
Membrany enzymatyczne lub bioreaktory membranowe. Membrany są polimerami złożonymi z chlorku poliwinylu, polipropylenu lub polisulfonu. Powinny byś hydrofilowe oraz mechanicznie wytrzymałe, dobrze znoszące różnice ciśnień oraz inne oddziaływania mechaniczne. Membrany enzymatyczne są to membrany o selektywnych właściwościach transportowych, zawierających w swojej strukturze zimmobilizowane biokatalizatory. W bioreaktorach membranowych enzymy lub całe komórki, choś nie związane fizycznie z nośnikiem, są uwięzione w przestrzeni ograniczonej przez membrany.
Metody chemiczne:
Kowalencyjne wiązanie z nośnikiem. Wytworzenie wiązań chemicznych między określonymi centrami aktywnymi enzymu lub składników ściany komórkowej mikroorganizmów a odpowiednim nośnikiem. Stosowane są głównie nośniki oraz związki chemiczne wiążące takie jak hydroksyalkilometakrylan + aldehyd glutarowy, karboksymetyloceluloza + karboimid itd. Wiązanie biokatalizatora z nośnikiem może zachodzić dzięki tworzeniu wiązań peptydowych, estrowych, typu węgiel-węgiel, węgiel-azot itp.
Sieciowanie związkami wielofunkcyjnymi. Działanie na biokatalizatory związkami chemicznymi w wyniku czego powstaje żelowy precypitat. Najczęściej stosowane odczynniki wielofunkcyjne: aldehyd glutarowy, diimidoetery, diizocjaniny.
Kopolimeryzacja. Biokatalizator jest poddawany modyfikacji chemicznej za pomocą substancji o podwójnych wiązaniach chemicznych, a następnie poddany polimeryzacji lub polikondensacji z monomerami jedno- lub dwufunkcyjnymi. Do modyfikacji stosuje się chlorki, azydki, bezwodniki kwasowe itp. Do polikondensacji- akryloamid, związki N-winylowe.
Wykorzystana literatura:
„Biotechnologia żywności” Praca zbiorowa pod redakcją Włodzimierza Bednarskiego i Arnolda Repsa.
Cel ćwiczenia:
Poznanie metody immobilizacji drobnoustrojów w alginianie wapnia
Sprawdzenie stabilności matrycy alginianowej w różnych środowiskach
Określenie efektywności działania immobilizowanej β-fruktofuranozydazy w reakcji hydrolizy sacharozy
Wykonanie ćwiczenia:
Immobilizacja drobnoustrojów metodą pułapkowania w alginianie wapnia:
Łączymy roztwór alginianu sodu z zawiesiną komórek drobnoustrojów (drożdży) w stosunku 1:1, mieszamy, odpowietrzamy. Tak uzyskaną zawiesiną komórek w alginianie napełniamy pojemnik strzykawki, zakładamy igłę i wkraplamy ją do oziębionego roztworu chlorku wapnia, przy delikatnym mieszaniu na mieszadle magnetycznym. Powstałe w efekcie jonotropowego żelowania alginianu jonami wapnia sferyczne formy żelu pozostawiamy do utwardzenia przez ok. 30 min, następnie oddzielamy je na sitku, przepłukujemy wodą.
Sprawdzamy stabilność nośnika alginianowego (kulek zawierających pułapkowane komórki) w środowisku soli fizjologicznej, roztworu cytrynianu, roztworu fosforanu i EDTA (wersenianu sodowo-potasowego). W tym celu umieszczamy jednakowe porcje kulek (5 sztuk) w probówkach w wymienionymi roztworami (objętość ok. 3-5 ml) i pozostawiamy je w tych środowiskach na 15-30 minut, często mieszamy zawartość. Obserwujemy zmiany zachodzące w probówkach.
Probówka z solą fizjologiczną- brak zmian
Probówka z fosforanem- kulki się rozpadły (osad), uwolniły się drożdże.
Probówka z cytrynianem- obserwujemy zmętnienie (rozpuszczenie, rozpad kulek) i opalizację (od drożdży)
Probówka z EDTA- nie obserwujemy zmian
Zastosowanie immobilizowanej β-fruktofuranozydazy do hydrolizy sacharozy.
Określenie stężenia cukrów redukujących w hydrolizatach sacharozy (metoda Samogoy-Nelsona):
Do 8 kuleczek, które ważą 160 mg (zawartość inwertazy: 40 μg/g.) dodajemy 10 ml 3% roztworu sacharozy, umieszczamy w termostatowej wstrząsarce o temperaturze 40oC (próba właściwa). Jednocześnie we wstrząsarce umieszczamy drugą buteleczkę zawierającą roztwór sacharozy bez preparatu enzymu (kuleczek). Próby wstrząsamy przez 30 minut w temperaturze 40oC. Po tym czasie Wyjmujemy próby i zlewamy ciecz znad kulek. Rozcieńczamy 5 krotnie. Do probówek pobieramy po 1 cm3 rozcieńczonych próbek i do każdej dodajemy po 1 cm3 odczynnika miedziowego. Próbki wstawiamy do wrzącej łaźni wodnej i gotujemy 10 minut, po tym czasie natychmiast ochładzamy probówki. Do każdej próby dodajemy po 1 cm3 roztworu Nelsona i dokładnie mieszamy. Po 10 minutach mierzymy absorbancję prób (właściwej i materiałowej) wobec próby odczynnikowej przy długości fali 520 nm.
Tabela zbiorcza wyników:
|
Masa kuleczek m [mg] |
ΔE520 |
R |
V 3% sacharozy [ml] |
Preparat nr. 1 51 μg inwertazy/ 1 g żelu |
73 |
|
5 |
10 10 10 10 |
Preparat nr. 2 40 μg inwertazy/ 1 g żelu |
160 |
|
5
|
10 10 10 10 |
Próba materiałowa |
-
|
|
1 |
10 10 |
Stężenie cukrów redukujących obliczamy według wzoru:
C [μmol/cm3]= K∗ΔE520∗R
Gdzie:
K [μmol/cm3]- współczynnik obliczony na podstawie krzywej wzorcowej.
K=0,5 [μmolCR/ml]
ΔE520- różnica absorbancji między badaną próbą (właściwą lub materiałową) a odczynnikową przy długości fali 520 nm
R- rozcieńczenie próby przed analizą
ΔE520 ŚR=0,308 -dla preparatu 1
ΔE520 ŚR=0,310 -dla preparatu 2
C dla preparatu 1:
C1=0,5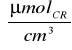
∗0,308∗5=0,77 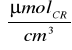
C dla preparatu 2:
C2=0,5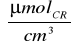
∗0,310∗5=0,775 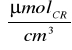
![]()
=0,269
C mat.=0,5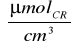
∗0,269∗1=0,135 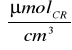
ΔC1=C1-Cmat=0,770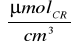
-0,135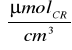
=0,635 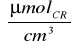
ΔC2=C2-Cmat=0,775
-0,135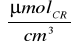
=0,640 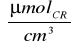
Aktywność immobilizowanego preparatu β-fruktofuranozydazy:
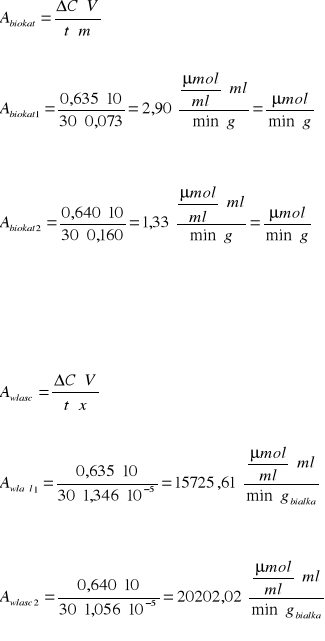
Gdzie:
Dla preparatu 1.: Cinwertazy w 1g żelu-51 µg
Dla preparatu 2.: Cinwertazy w 1g żelu-40 µg
Stosowane na zajęciach immobilizowane preparaty zawierają inwertazę drożdżową.
Zawiera ona 0,264g białka w 1g handlowego preparatu rozpuszczalnej inwertazy.
x1:
1 g inwertazy - 0,264 g białka
51∗10-6 g inwetrazy - x g białka
x= (0,264 g białka ∗ 51∗10-6 g inwertazy) / 1 g inwertazy = 1,346∗10-5 g białka
x2:
1 g inwertazy - 0,264 g białka
40∗10-6 g inwertazy - x g białka
x= (0,264 g białka ∗ 40∗10-6 g inwertazy) / 1 g inwertazy =1,056∗10-5 g białka
Wnioski:
Stabilność nośnika alginianowego zmienia się w zależności od środowiska. W roztworze soli fizjologicznej nie zaobserwowałyśmy zmian. W probówce, w której znajdował się roztwór fosforanu i żelowe kuleczki wytrącił się osad fosforanu wapnia, zaobserwowałyśmy opalizację, co świadczyło o uwolnieniu komórek drożdży. W probówce z roztworem cytrynianu w wyniku rozpadu żelowych kulek uwolniły się drożdże, była ona mętna. W probówce z EDTA nastąpiło rozluźnienie struktury kulek, które było wyczuwalne po wyjęciu kulek z roztworu (próba mechaniczna), nastąpiło związanie jonów wapnia. Wynika z tego, że w środowiskach w których znajdują się fosforany, kwasy organiczne i związki kompleksujące matryca alginianowa nie powinna byś stosowana.
Dzięki temu, że do hydrolizy sacharozy zastosowaliśmy immobilizowną β-fruktofuranozydazę, policzyliśmy stężenie cukrów redukujących, które wynosiło:
Dla preparatu 1: 0,770 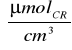
Dla preparatu 2: 0,775 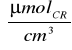
Aktywność immobilizowanego preparatu β-fruktofuranozydazy w przeliczeniu na 1g immobilizowanego biokatalizatora wynosiła:
Dla preparatu 1: 2,90 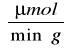
Dla preparatu 2: 1,33 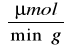
Aktywność w przeliczeniu na 1 g białka zawartego w preparacie inwertazy wynosiła:
Dla preparatu 1: 15725,61 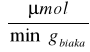
Dla preparatu 2: 20202,02 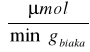
Błędy w otrzymanych wynikach mogą wynikać z niedokładności wykonywanych pomiarów.
Wyszukiwarka
Podobne podstrony:
B II W03, studia, bio, 4rok, 8sem, biotechnologia2, wykład
B II W12, studia, bio, 4rok, 8sem, biotechnologia2, wykład
B II W01, studia, bio, 4rok, 8sem, biotechnologia2, wykład
iMMOBILIZACJA BIOkatalizatorów, studia, bio, 4rok, 8sem, biotechnologia2, lab
B II W02, studia, bio, 4rok, 8sem, biotechnologia2, wykład
mutagenizacja, studia, bio, 4rok, 8sem, biotechnologia2, lab
Mikro lab coll 1, studia, bio, 4rok, 8sem, mikrobiologia przemysłowa, lab
inżynieria genetyczna, studia, bio, 4rok, 8sem, inzynieria genetyczna, lab
koło lab, studia, bio, 4rok, 7sem, biotechnologia środowiska, lab, teoria
czesc-wykladow, studia, bio, 4rok, 7sem, biotechnologia środowiska, wykład
spr-kofeina, studia, bio, 4rok, 7sem, fakultet chemia żywności, lab
spr-olejki eteryczne, studia, bio, 4rok, 7sem, fakultet chemia żywności, lab
w2, studia, bio, 4rok, 7sem, inżynieria bioprocesowa i bioreaktorowa, bioprocesy (1 koło)
w5, studia, bio, 4rok, 7sem, inżynieria bioprocesowa i bioreaktorowa, bioprocesy (1 koło)
w4, studia, bio, 4rok, 7sem, inżynieria bioprocesowa i bioreaktorowa, bioprocesy (1 koło)
w6, studia, bio, 4rok, 7sem, inżynieria bioprocesowa i bioreaktorowa, bioprocesy (1 koło)
cz1, studia, bio, 4rok, 7sem, fakultet chemia żywności, wykład
cz3, studia, bio, 4rok, 7sem, fakultet chemia żywności, wykład
cz4, studia, bio, 4rok, 7sem, fakultet chemia żywności, wykład
więcej podobnych podstron