Przygotowanie i mianowanie roztworu HCl o stężeniu 0,1 mol/dm3
Przygotowanie roztworu HCl
Wykonanie ćwiczenia:
W celu przygotowania 500 cm3 roztworu HCl o stężeniu około 0,1 mol/dm3 korzystamy ze stężonego kwasu solnego o gęstości 1,090g/cm3.
Obliczenia:
MHCl = 1 + 35,5 = 36,5
1000cm3 1 mol/dm3 - 36,5g
500 cm3 0,1 mol/dm3 - Xg
XHCl = ![]()
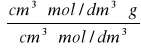
= 1,825g
Znając gęstość kwasu, możemy z tabeli odczytać stężenie procentowe HCl w jego wodnym roztworze, a następnie obliczyć ile gramów stężonego HCl zawiera 1,825g czystego HCl:
W 100g stężonego HCl - 18,43g HCl
W xg stężonego HCl - 1,825g HCl
XHCl = ![]()
= 9,90g
Korzystając z podanej gęstości (d) stężonego kwasu solnego i obliczonej masy (m) obliczamy potrzebną objętość roztworu (V):
d = ![]()
⇒ V = ![]()
V = ![]()
Do kolby miarowej o pojemności 500 cm3 odmierzamy cylindrem miarowym 9,1cm3 stężonego HCl, następnie zawartość kolby uzupełniamy wodą destylowaną do kreski.
Mianowanie roztworu HCl
Wykonanie ćwiczenia:
Do mianowania roztworu kwasu solnego najpierw na wadze analitycznej odmierzamy około 1g Na2CO3 (z dokładnością do czwartego miejsca po przecinku), przenosimy naważkę do kolby miarowej (100cm3) i uzupełniamy wodą destylowaną do kreski. Następnie odmierzamy pipetą 10 cm3 tak otrzymanego roztworu, przelewamy do kolby stożkowej i dodajemy dwie krople oranżu metylowego, po czym miareczkujemy (z biurety) przygotowanym roztworem HCl do zmiany zabarwienia z barwy żółtej na pomarańczową. Miareczkowanie wykonujemy dwukrotnie i odczytujemy zużytą ilość roztworu HCl. Obliczamy stężenie roztworu HCl.
Obliczenia:
Na2CO3 + 2HCl →2NaCl + CO2 + H2O
Z równania zachodzącej reakcji wynika, że 1 Na2CO3 reaguje z 2 molami HCl.
C = ![]()
M![]()
= 2⋅23 + 12 + 3⋅16 = 106g/mol
m = 1,066g
V = 100cm3
Stężenie molowe Na2CO3 wynosi więc:
C = ![]()
Więc stężenie HCl wynosi:
CHCl = ![]()
V - objętość Na2CO3 = 10cm3
C - stężenie Na2CO3 = 0,1006mol/dm3
VHCl - objętość HCl jaka zeszła z biurety = 18,1cm3
CHCl = 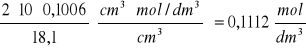
Wnioski:
Z naszego doświadczenia wyszło, że stężenie molowe przygotowanego przez nas roztworu kwasu solnego wynosi 0,1112 mol/dm3.
Wyszukiwarka
Podobne podstrony:
miareczkownie, NAUKA, chemia, lab
Równowaga w roztworach elektrolitów, NAUKA, chemia, lab
pat sciąga chemia zerówka, NAUKA, chemia, lab
Masa atomowa i cząsteczkowa, NAUKA, chemia, lab
Na ciała poruszające się w cieczy, NAUKA, chemia, lab
Oznaczenie miedzi, NAUKA, chemia, lab
grupy pierwsiatkow chemia, NAUKA, chemia, lab
adsorp, NAUKA, chemia, lab
chemia7, NAUKA, chemia, lab
chemia2, NAUKA, chemia, lab
Spektrofotometria S-3, NAUKA, chemia, lab
E -4, NAUKA, chemia, lab
Politechnika Białostocka, NAUKA, chemia, lab
chemia tabelki 3, NAUKA, chemia, lab
Konduktometriaaa, NAUKA, chemia, lab
chemia zerókapat, NAUKA, chemia, lab
więcej podobnych podstron