Robert Maniura
Sprawozdanie z ćwiczenia nr 29: Wyznaczanie stałej szybkości reakcji zmydlania estru.
Wstęp teoretyczny:
Katalizatorami nazywamy substancje przyśpieszające reakcje chemiczne, pozostające w niezmienionej ilości po zakończeniu reakcji. Charakterystyczne jest przy tym, że bardzo małe ilości substancji katalitycznej, w porównaniu z ilościami substratów, mogą mieć bardzo silny wpływ na szybkość reakcji.
W roztworach szczególnie jest rozpowszechniona kataliza kwasowo - zasadowa. Dzieje się tak dlatego, że przyłączenie lub oderwanie protonu od cząsteczki zmienia w istotny sposób jej reaktywność. Z drugiej strony równowagi protolitycznej, zwłaszcza w roztworze wodnym, są bardzo pospolite.
W przypadku hydrolizy estrów katalizowanej kwasami, pierwszym etapem reakcji jest przyłączenie protonu do tlenu karbonylowego. Powstający kation, w którym ładunek dodatni w wyniku przemieszczenia gęstości elektronowej jest w znacznym stopniu zlokalizowany na atomie węgla (jon karboniowy), znacznie łatwiej przyłącza cząsteczkę wody. Kation taki jest nietrwały, a odszczepienie grupy metoksylowej jest znacznie łatwiejsze. Reakcję katalizowaną przez kwas można przedstawić:
S +AH ![]()
SH+ + A- ![]()
P + AH (*) gdzie: S- substrat, P - produkt;
Sposób zapisu reakcji wykazuje równocześnie, że kwas katalizuje także reakcje odwrotną, co jest ogólną cechą katalizatorów. Działanie katalityczne kwasu, zależy od łatwości odszczepiania od niego protonu tzn. od stałej równowagi dysocjacji AH![]()
A- + H+, a nie od rodzaju kwasu.
W przypadku hydrolizy estrów katalizowanej zasadami, pierwszym etapem reakcji jest przyłączenie grupy hydroksylowej do reszty alkoholowej (C2H5-) i powstaje anion reszty kwasowej. Szybkość reakcji hydrolizy zależy w tym wypadku od stężenia jonów -OH-, gdyż biorą one rzeczywisty udział w reakcji.
Hydroliza estrów należy do typowych reakcji katalizowanych kwasami lub zasadami. Zadanie polega na wyznaczeniu stałej szybkości reakcji hydrolizy katalizowanej zasadą (zmydlanie), a więc jonów wodorotlenowych metodą pomiaru zmian przewodnictwa elektrycznego.
Zmydlanie estru można zapisać w następujący sposób:
CH3COOC2H5 + NaOH → CH3COONa + C2H5OH
Opracowanie wyników:
Wyniki pomiarów zestawiam w tabeli: dla temperatury 20oC
t [min] |
t [s] |
Zmierzone Gt [S] w odpowiednim czasie t (w temperaturze 200C) |
Obliczone |
0 |
0 |
0,0039 = G0 |
|
0,5 |
30 |
0,00385 |
1,66667E-06 |
1 |
60 |
0,0038 |
1,66667E-06 |
1,5 |
90 |
0,00375 |
1,66667E-06 |
2 |
120 |
0,0037 |
1,66667E-06 |
2,5 |
150 |
0,00365 |
1,66667E-06 |
3 |
180 |
0,0036 |
1,66667E-06 |
3,5 |
210 |
0,00355 |
1,66667E-06 |
4 |
240 |
0,0035 |
1,66667E-06 |
4,5 |
270 |
0,00345 |
1,66667E-06 |
5 |
300 |
0,0034 |
1,66667E-06 |
6 |
360 |
0,00335 |
1,52778E-06 |
7 |
420 |
0,0033 |
1,42857E-06 |
8 |
480 |
0,00325 |
1,35417E-06 |
9 |
540 |
0,0032 |
1,2963E-06 |
10 |
600 |
0,0031 |
1,33333E-06 |
12 |
720 |
0,00305 |
1,18056E-06 |
14 |
840 |
0,00295 |
1,13095E-06 |
16 |
960 |
0,00285 |
1,09375E-06 |
18 |
1080 |
0,00275 |
1,06481E-06 |
20 |
1200 |
0,00265 |
1,04167E-06 |
25 |
1500 |
0,0026 |
8,66667E-07 |
30 |
1800 |
0,0024 |
8,33333E-07 |
35 |
2100 |
0,0023 |
7,61905E-07 |
40 |
2400 |
0,0022 |
7,08333E-07 |
45 |
2700 |
0,0021 |
6,66667E-07 |
50 |
3000 |
0,002 |
6,33333E-07 |
55 |
3300 |
0,00195 |
5,90909E-07 |
60 |
3600 |
0,00195 |
5,41667E-07 |
90 |
5400 |
0,00172 |
4,03704E-07 |
Dla temperatury 40oC:
t [min] |
t [s] |
Zmierzone Gt [S] w odpowiednim czasie t (w temperaturze 200C) |
Obliczone |
0 |
0 |
0,0049 = Go |
|
0,5 |
30 |
0,00485 |
1,67E-06 |
1 |
60 |
0,0047 |
3,33E-06 |
1,5 |
90 |
0,0046 |
3,33E-06 |
2 |
120 |
0,0045 |
3,33E-06 |
2,5 |
150 |
0,0043 |
4,00E-06 |
3 |
180 |
0,0042 |
3,89E-06 |
3,5 |
210 |
0,0041 |
3,81E-06 |
4 |
240 |
0,004 |
3,75E-06 |
4,5 |
270 |
0,00395 |
3,52E-06 |
5,5 |
330 |
0,00385 |
3,18E-06 |
6,5 |
390 |
0,0038 |
2,82E-06 |
7,5 |
450 |
0,0037 |
2,67E-06 |
8,5 |
510 |
0,0036 |
2,55E-06 |
9,5 |
570 |
0,0034 |
2,63E-06 |
11,5 |
690 |
0,0033 |
2,32E-06 |
13,5 |
810 |
0,00325 |
2,04E-06 |
15,5 |
930 |
0,0032 |
1,83E-06 |
17,5 |
1050 |
0,0031 |
1,71E-06 |
19,5 |
1170 |
0,003 |
1,62E-06 |
24,5 |
1470 |
0,0029 |
1,36E-06 |
29,5 |
1770 |
0,0028 |
1,19E-06 |
34,5 |
2070 |
0,0027 |
1,06E-06 |
39,5 |
2370 |
0,0025 |
1,01E-06 |
Z danych zawartych w tabelach wyznaczam wykresy zależności 
:
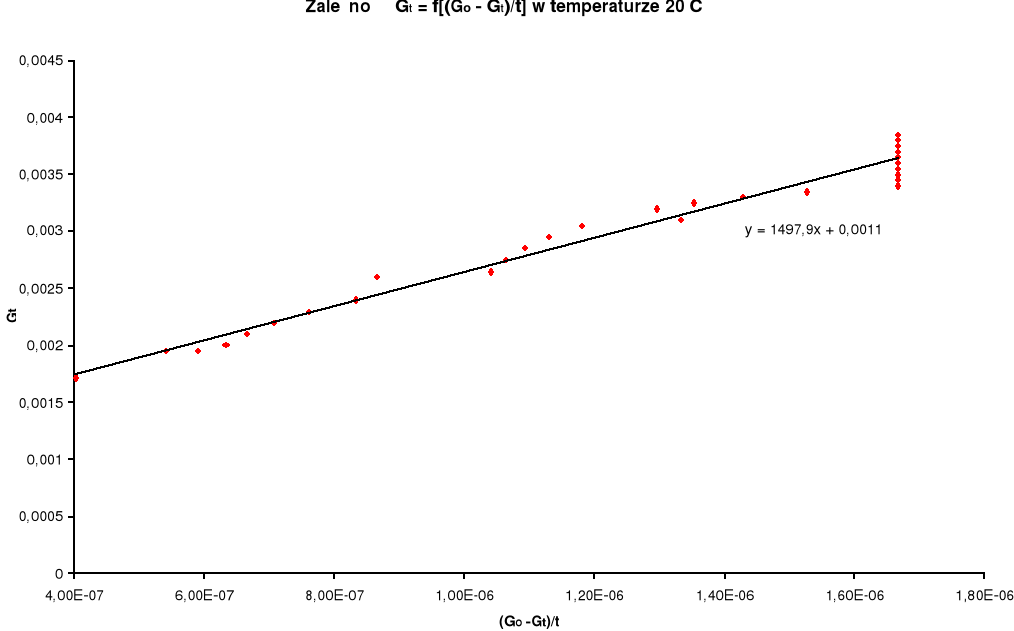
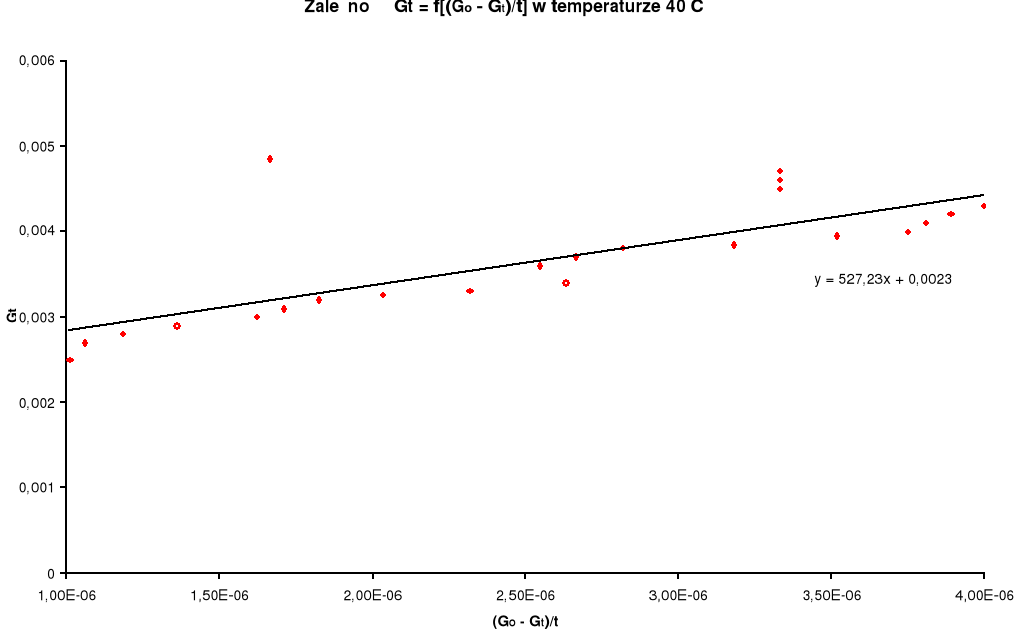
Aby wyznaczyć współczynnik kierunkowy z równania ![]()
(czyli wyrażenie ![]()
) wykorzystam równania prostych z wykresów, które mają ogólny wzór y = ax + b (gdzie: y = Gt; ![]()
; ![]()
; a = ![]()
). Stałą szybkości zmydlania obliczam z równania a = ![]()
:
![]()
(gdzie: ![]()
)
dla temperatury 20oC: k1 = 1/(0,01*1497,9) = 6,68*10-2 [s-1]
dla temperatury 40oC: k2 = 1/(0,01*527,23) = 1,90*10-1 [s-1]
Na podstawie wyznaczonych stałych szybkości reakcji zmydlania estru obliczam energię aktywacji korzystając z równania ![]()
:
![]()
(gdzie: G0, 20C = 0,0039 [S]; G0, 40C = 0,0049 [S])
dla temperatury 20oC: ![]()
[J/mol]
dla temperatury 40oC: ![]()
[J/mol]
Wnioski:
Wartości stałych szybkości zmydlania estru wskazują, że reakcja ta jest reakcją szybką i nieodwracalną. Wraz ze wzrostem temperatury wzrasta szybkość reakcji i wartość stałej szybkości. Energia aktywacji również wskazuje, że reakcja zmydlania jest nieodwracalna ponieważ jej wartość jest ujemna i wraz ze wzrostem temperatury jej wartość jest coraz niższa. Podczas reakcji hydrolizy estru katalizowanej zasadą wykazuje się tendencja do przesunięcia równowagi chemicznej w kierunku produktów.
1
Wyszukiwarka
Podobne podstrony:
wyznaczanie stałej szybkości zmydlania estru, Chemia fizyczna, laboratorium, Chemia fizyczna
Wyznaczanie stopnia asocjacji kwasu octowego w rozpuszczalni, Studia, Politechnika
Wyznaczanie potencjału desorpcji związków powierzchniowo akt, Studia, Politechnika
Wyznaczanie stałej szybkości reakcji zmydlania estru
Wyznaczanie stalej szybkosci reakcji zmydlania octanu etylu metoda konduktometryczna DOC
Wyznaczanie stałej balistycznej galwanometru balistycznego, Politechnika Lubelska, Studia, Studia, s
Sprawozdanie - Kinetyka chemiczna. Wyznaczenie stałej szybkości, Studia, Chemia
Wyznaczanie rzędu reakcji metodą graficzną, Studia, Politechnika
chemia sprawko Wyznaczanie stałej szybkości reakcji
2003 chemia sprawko Wyznaczanie stałej szybkości reakcji
Martynaa chemia sprawko Wyznaczanie stałej szybkości reakcji
chemia sprawko Wyznaczanie stałej szybkości reakcji
27 Wyznaczanie stałej szybkości i rzędu reakcji metodą graf
Wyznaczanie bezwzgl dnej aktywno ci promieniowania b v2, Politechnika Lubelska, Studia, Studia, mate
308. Wyznaczanie współczynnika światła dla cieczy za pomocą refraktometru Abbego, studia, studia Pol
potencjal wojtek, Studia Politechnika Poznańska, Semestr I, Chemia, Chemia laboratoria, Wyznaczanie
Wyznaczanie stałej Verdeta v2, Pracownia Zakładu Fizyki Technicznej Politechniki Lubelskiej
309. Wyznaczanie sprawności świetlnej żarówki za pomocą fotometru, studia, studia Politechnika Pozna
więcej podobnych podstron