GRUPA |
ZESPÓŁ |
ĆWICZENIE |
DATA |
OCENA |
|
33
|
4
|
8
|
21.11.2000
|
|
|
IMIĘ I NAZWISKO |
TEMAT |
ĆWICZENIA |
|||
Anna Chrzan Dominika Heród Grzegorz Leszczyński |
Pomiar siły elektromotorycznej ogniw i potencjałów półogniw
|
||||
1. WSTĘP TEORETYCZNY:
Elektrodą (półogniwem) w elektrochemii nazywa się układ złożony z dwóch faz przewodzących, z których przynajmniej jedną jest elektrolit. Elektrodę stanowi najczęściej faza metaliczna, granicząca z elektrolitem. Fazy te graniczą ze sobą w ten sposób, że możliwy jest przepływ jonów lub elektronów przez powierzchnie między fazowe. Każdy metal w zetknięciu z roztworem elektrolitu wykazuje dążność do przechodzenia do roztworu w postaci jonowej. Elektrodę na której zachodzi proces utleniania nazywa się anodą, zaś tę na której zachodzi proces redukcji- katodą
Wartość potencjału elektrody zależy od właściwości metalu, stężenia kationu(aktywności) i temperatury.
Zależność potencjału elektrody od aktywności jonu metalu w roztworze, liczby elektronów biorących udział w reakcji i temperatury przedstawia równanie Nernsta:
E = E0 + (RT/nF) ln aM/aM
Gdzie: E0 - normalny potencjał elektrody
R - stała gazowa
T - temperatura bezwzględna
F - stała Faradaya
n - liczba elektronów biorących udział w reakcji
aM - aktywność jonów metalu
Ogniwa galwaniczne zbudowane są z dwóch elektrod współpracujących z roztworem elektrolitu. Elektrolit może być wspólny, ale częściej występują dwa elektrolity, dla każdej elektrody inny i wówczas kontakt między roztworami elektrolitu realizowany jest przez klucz elektrolityczny. Zachodzi tu proces przemiany energii chemicznej w energię elektryczną, możliwą do zmierzenia i praktycznego wykorzystania.
Siła elektromotoryczna ogniwa równa jest różnicy między potencjałem przewodnika przyłączonego do elektrody prawej a potencjałem przewodnika z tego samego materiału dołączonego do elektrody lewej. W ogniwie występuje bezpośredni związek między siłą elektromotoryczną ogniwa i zmianą swobodnej energii Gibbsa dla samożutnych reakcji w ogniwie:
∆G = - nEF
Ogniwa stężeniowe określa się jako ogniwa galwaniczne, w których praca elektryczna powstaje w skutek wyrównania się stężeń elektrolitu. Ogniwo stężeniowe składa się z dwóch takich samych elektrod zanurzonych w roztworach o różnych stężeniach. Schemat takiego ogniwa jest następujący:
Me (c1) roztwór MeR Me (c2)
І ІІ
Jeżeli c1< c2, to elektroda І jest elektrodą ujemną. Elektroda ІІ jest w tym ogniwie elektrodą dodatnią.
Siła elektromotoryczna ogniwa stężeniowego zależy tylko od stosunku aktywności katonów w obu roztworach. Nie zależy ona natomiast od potencjału normalnego metalu, z którego sporządzono elektrody.
2. CEL ĆWICZENIA:
- pomiar potencjałów określonych półogniw
- wyznaczenie SEM ogniwa z pomiarów potencjałów półogniw
- wyznaczenie zmiany potencjału termodynamicznego ∆G reakcji zachodzących w ogniwie
- pomiar siły elektromotorycznej określonego ogniwa
- wyznaczenie zmiany potencjału termodynamicznego ∆G reakcji zachodzących w ogniwie
3. APARATURA I MATERIAŁY:
- woltomierz cyfrowy, termostat, kable z końcówkami, elektrody Cd i Fe, elektroda chlorosrebrowa, klucz elektrolityczny, szkło laboratoryjne.
4. ODCZYNNIKI:
- azotan kadmowy
- azotan żelazowy
- chlorek potasu
5. WYKONANIE ĆWICZENIA:
Pomiar SEM dokonujemy za pomocą:
Lp.
|
Półogniwo 1 Cd / Cd(NO3)2 |
Półogniwo 2 Fe / Fe(NO3)3 |
Temperatura |
|
Stężenie elektrolitu |
Stężenie elektrolitu |
[0C] |
1. |
0,05n = 0,025 [mol/dm3] |
0,1n = 0,03 [mol/dm3] |
20 i 25 |
a) pomiar potencjałów półogniw
- przygotowujemy w małych zlewkach r-ry elektrolitów
- nastawiamy termostat na żądaną temperaturę
- zlewkę z roztworem elektrolitu umieszczamy w termostacie
- po osiągnięciu przez elektrolit zadanej temperatury wkładamy do zlewki elektrodę metalową oraz elektrodę chlorosrebrową
- łączymy elektrody z woltomierzem cyfrowym
- mierzymy różnicę potencjałów między zadanym półogniwem a elektrodą chlorosrebrową w danej temperaturze
Wyniki pomiarów:
- dla półogniwa Fe/Fe(NO3)3
Lp.
|
T[0C] |
E0 CL-/AgCl, Ag/Fe/Fe(NO3)3 |
V0 Cl-/ AgCl, Ag [V] |
V0 Fe/ Fe(NO3)3 |
1 |
20 |
- 0,2616 |
+ 0,1981 |
- 0,4597 |
2 |
25 |
- 0,2428 |
+ 0,1940 |
- 0,4368 |
Schemat reakcji:
Katoda: Fe3+ + 3e = Fe
Anoda: Ag + Cl- = AgCl + e /٠3
Fe3+ + 3Ag + 3CL- = 3AgCl + Fe
Obliczenie V0 Fe/ Fe(NO3)3 dla T = 200C
E0 = V0 Fe3+/Fe + V0 Cl- / AgCl, Ag
V0 Fe3+/ Fe = E0 - V0 Cl- / AgCL, Ag = - 0,2616 - 0,1981 = - 0,4597
- dla T= 250C
V0 Fe3+/ Fe = - 0,2428 - 0,1940 = - 0,4368
- dla półogniwa Cd/ Cd(NO3)3
Lp.
|
T[0C] |
E0 Cl- / AgCL, Ag/ Cd/Cd(NO3)3 |
V0 Cl- / AgCl, Ag |
V0 Cd2+/ Cd |
1 |
20 |
0,6062 |
+0,1981 |
0,4081 |
2 |
25 |
0,5958 |
+0,1940 |
0,4018 |
Schemat reakcji:
Katoda: Cd2+ + 2e = Cd
Anoda: Ag + Cl- = AgCl + e /٠2
Cd2+ + 2Ag + 2Cl- = 2AgCl + Cd
Obliczenie V0 Cd2+/Cd
- dla T = 200C
E0 = V0 Cl- / AgCl, Ag + V0 Cd2+/ Cd
V0 Cd2+/ Cd = E0 - V0 Cl- /AgCl, Ag = 0,4081
- dla T = 250C
V0 = 0,5958 - 0,1940 = 0,4018
b) pomiar siły elektromotorycznej ogniw:
- przygotowujemy w małych zlewkach r- ry elektrolitów
- zlewki z roztworami elektrolitów umieszczamy w termostacie
- po osiągnięciu przez elektrolity zadanej temperatury wkładamy do zlewek odpowiednie elektrody metalowe
- łączymy zlewki z elektrolitami kluczem elektrolitycznym
- elektrody łączymy z woltomierzem cyfrowym
- mierzymy różnicę potencjałów między elektrodami
Wyniki pomiarów:
Lp. |
T[0C] |
E Cd/Cd(NO3)2/ Fe/Fe(NO3)3 |
E[V] |
1 |
20 |
0,726 |
0,723 |
2 |
25 |
0,773 |
0,769 |
Anoda: Cd = Cd2+ 2e /٠3
Katoda: Fe3+ + 3e = Fe /٠2
3Cd + 2Fe3+ = 3Cd2+ + 2Fe
Siłę elektromotoryczną obliczamy z równania NERNSTA:
E = E0 - 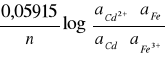
aFe ; a Cd = 1
a Cd2+ = f± · cCd2+
log f± = - 0,509 · z+·z-·![]()
I
I = ![]()
I = 0,075
f± = 0,53
aCd2+ = f±·c = 0,013
I = 0,165
f± = 0,207
aFe3+ = 0,00621
dla T = 200C
E = 0,726 - ![]()
= 0,723
Dla T = 250C
E = 0,769
c) obliczenie ∆G reakcji zachodzących w ogniwach z wykorzystaniem pomiarów SEM ogniw
Cl- / AgCl, Ag // Fe / Fe(NO3)3
∆G0 = -n F E0
dla T = 200C
∆G0 = -3·96500·(- 0,2616)
∆G0 = 75733 [J]
∆G = ∆G0 + RTln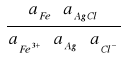
aCl- = f±·cCl_
I = 5
f± = 0,0053
∆G = 100881 [J]
dla T = 250C
∆G0 = 70291 [J]
∆G = 101295 [J]
Cl- / AgCl, Ag // Cd / Cd(NO3)2
- dla T = 200C
∆G0 = -116997 [J]
∆G = -99259 [J]
- dla T = 250C
∆G0 = -114951[J]
∆G = -96921 [J]
Fe / Fe(NO3)3 // Cd / Cd(NO3)2
∆G0 = -140118 [J]
∆G = -140118 [J]
6. WNIOSKI:
Eektrody odwracalne sporządzone z metali w stanie stałym tworzą ogniwa dla których powtarzalność wartości pomiarów SEM jest utrudniona. Wynika to głównie z własności tych metali. Na błąd pomiarów ma wpływ niedoskonałość metody kompensacyjnej, w której oznaką osiągnięcia stanu równowagi jest brak przepływu prądu w gałęzi, w której znajduje się ogniwo i czuły galwanometr (wskażnik zera). W zasadzie metoda ta nie zapewnia całkowitego braku przepływu prądu przez badane ogniwo w momencie kompensacji.
Wyszukiwarka
Podobne podstrony:
5726
5726
5726
5726, scenariusze zajęć z internetu
5726
5726
5726
5726
5726
5726
5726
więcej podobnych podstron