KWASY I ZASADY wg ARRHENIUSA
Kwasy są to związki chemiczne, które podczas rozpuszczania w wodzie dysocjują całkowicie lub częściowo na kationy wodorowe i aniony reszt kwasowych.
Równania reakcji dysocjacji podstawowych kwasów:
HCl --> H+ + Cl -
1 cząsteczka kwasu solnego dysocjuje na 1 kation wodoru i 1 anion chlorkowy
H2S <==> 2 H+ + S2 -
1 cząsteczka kwasu siarkowodorowego dysocjuje na 2 kationy wodoru i 1 anion siarczkowy
HNO3 --> H+ + NO3 -
1 cząsteczka kwasu azotowego (V) dysocjuje na 1 kation wodoru i 1 anion azotanowy (V)
H2SO4 --> 2 H+ + SO42 -
1 cząsteczka kwasu siarkowego (VI) dysocjuje na 2 kationy wodoru i 1 anion siarczanowy (VI)
H2SO3 <==> 2 H+ + SO32 -
1 cząsteczka kwasu siarkowego (IV) dysocjuje na 2 kationy wodoru i 1 anion siarczanowy (IV)
H2CO3 <==> 2 H+ + CO32 -
1 cząsteczka kwasu węglowego dysocjuje na 2 kationy wodoru i 1 anion węglanowy
H3PO4 <==> 3 H+ + PO43 -
1 cząsteczka kwasu fosforowego (V) dysocjuje na 3 kationy wodoru i 1 anion fosforanowy (V)
Kwasy, które w czasie dysocjacji odczepiają jeden kation wodorowy nazywamy jednoprotonowymi.
Kwasy posiadające w cząsteczkach więcej niż jeden atom wodoru nazywamy:
dwuprotonowymi - odczepiają dwa kationy wodorowe,
trójprotonowymi - odczepiają trzy kationy wodorowe.
Wieloprotonowe kwasy dysocjują stopniowo.
W pierwszym etapie następuje odłączenie 1 kationu wodoru - dysocjacja pierwszego stopnia, w następnym etapie zachodzi odłączenie kolejnego kationu wodoru i tak do momentu, gdy wszystkie jony zdysocjują, np.:
I stopień dysocjaji:
H2SO4 --> H+ + HSO4 -
1 cząsteczka kwasu siarkowego (VI) dysocjuje na 1 kation wodoru i 1 anion wodorosiarczanowy (VI)
II stopień dysocjaji:
HSO4 - --> H+ + SO42 -
1 anion wodorosiarczanowy (VI) dysocjuje na 1 kation wodoru i 1 anion siarczanowy (VI)
Na pierwszym stopniu dysocjacji cząsteczki dysocjują najmocniej, a na kolejnych co raz słabiej (łatwiej przebiega dysocjacja na pierwszym stopniu niż na dalszych).
Zasady są to związki chemiczne, które podczas rozpuszczania w wodzie dysocjuja całkowicie lub częściowo na aniony wodorotlenowe OH - i kationy metali.
Równania dysocjacji niektórych zasad:
Na OH --> Na+ + OH -
1 cząsteczka wodorotlenku sodu dysocjuje na 1 kation sodu i 1 anion wodorotlenowy
K OH --> K+ + OH -
1 cząsteczka wodorotlenku potasu dysocjuje na 1 kation potasu i 1 anion wodorotlenowy
Ca (OH)2 --> Ca2 + + 2 OH -
1 cząsteczka wodorotlenku wapnia dysocjuje na 1 kation wapnia i 2 aniony wodorotlenowe
Substancje, które w roztworach wodnych ulegają prawie całkowitej dysocjacji nazywamy elektorlitami mocnymi. Należą do nich: HCl, HBr,HNO3, H2SO4, HClO4, NaOH, KOH, Ca(OH)2, Ba(OH)2.
Elektrolity słabe dysocjują nie więcej niż w 30% i są to między innymi: H2S, H2SO3, H2CO3, Mg(OH)2.
Miarą mocy elektrolitu jest stopień dysocjacji, który wyraża stosunek liczby moli cząsteczek zdysocjowanych, do liczby moli cząsteczek wprowadzonych do roztworu.
Stopień dysocjacji zależy od:
- rodzaju elektrolitu
- rodzaju rozpuszczalnika
- stężenia roztworu - wzrasta w miarę rozcieńczania roztworu
- temperatury - na ogół nieznacznie wzrasta wraz ze wzrostem temperatury
Stała dysocjacji - K, jest to stosunek iloczynu stężeń jonów do stężenia cząsteczek niezdysocjowanych. Nie zależy ona od stężenia elektrolitu, ale zależy od temperatury i rodzaju rozpuszczalnika.
Jest miarą mocy kwasu lub zasady. Im większa wartość stałej dysocjacji tym bardziej kwas lub zasada jest zdysocjowany.
Reakcje hydrolizy soli
Reakcje hydrolizy soli polegają na reakcji jonów tych soli z wodą. Reakcja ta powoduje, że roztwory niektórych soli wykazują odczyn słabo kwasowy, innych słabo zasadowy, a jeszcze innych obojętny. Ponieważ są to reakcje jonowe, więc hydrolizie ulegają tylko te sole, które po przereagowaniu z wodą utworzą słaby elektrolit:
- sól słabego kwasu i mocnej zasady, np.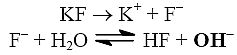
Jest to hydroliza anionowa. Odczyn wodnego roztworu takiej soli jest zasadowy.
- sól mocnego kwasu i słabej zasady, np.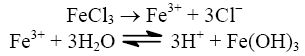
Jest to hydroliza kationowa. Odczyn wodnego roztworu takiej soli jest kwasowy.
- sól słabego kwasu i słabej zasady, np.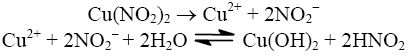
Jest to hydroliza kationowo-anionowa. Odczyn wodnego roztworu takiej soli jest albo obojętny, albo słabo kwasowy (kwaśny), albo słabo zasadowy, w zależności od tego, który z produktów tej reakcji jest lepiej zdysocjowany.
Sole mocnych kwasów i mocnych zasad nie ulegają hydrolizie. Ich odczyn w roztworach wodnych jest obojętny.
|
|
|
|
|
|
|
|
Reakcje hydrolizy soli
Platforma Edukacyjna - gotowe opracowania lekcji oraz testów.
|
|
|
Scenariusz leckji chemi dla uczniów klasy 1 liceum ogólnokształcącego przeprowadzonej w ramach zewnętrznego mierzenia jakości pracy szkoły.
SCENARIUSZ LEKCJI CHEMII W KLASIE PIERWSZEJ LO.
I. TEMAT LEKCJI: Reakcje hydrolizy soli.
Ø Cel dydaktyczny - uświadomienie różnej roli wody w procesach dysocjacji i hydrolizy
Ø Cel wychowawczy - rozwijanie dociekliwości i precyzji podczas pracy doświadczalnej i teoretycznej; - mobilizowanie do analitycznego podejścia do problemu.
Po lekcji uczeń powinien:
- znać istotę reakcji hydrolizy; - zapisywać równania reakcji w formie jonowej; - przewidywać odczyn wodnego roztworu soli rozpuszczalnej; - porównać rolę wody w procesie dysocjacji i hydrolizy.
- podająca, - problemowa, - praktyczna.
Kolby, wskaźniki kwasowo - zasadowe, roztwory wodne soli: ZnCl2, K2CO3, CH3COONH4, foliogramy, rzutnik pisma.
Przypomnienie:
Postawienie problemu: Jaki odczyn będą miały wodne roztwory soli?
Hipoteza uczniów: odczyn obojętny.
Uzasadnienie: w skład soli nie wchodzą ani jony H+, ani OH-.
Rozwiązanie problemu następuje po wykonaniu przez uczniów doświadczeń.
Uczniowie podzieleni na trzy grupy wykonują doświadczenia polegające na zbadaniu odczynu wodnych roztworów soli za pomocą wskaźników kwasowo - zasadowych według przygotowanych instrukcji. Przedstawiają poczynione obserwacje i wyciągnięte z nich wnioski.
GRUPA I: badanie odczynu wodnego roztworu ZnCl2.(odczyn kwasowy)
GRUPA II: badanie odczynu wodnego roztworu K2CO3. (odczyn zasadowy)
GRUPA III: badanie odczynu wodnego roztworu CH3COONH4 (odczyn obojętny),
NAUCZYCIEL: badanie odczynu wodnego roztworu NaCl (odczyn obojętny).
Wyjaśnienie problemu następuje z wykorzystaniem przygotowanych foliogramów.
Uczniowie otrzymują karteczki z wzorami soli. Na tablicy umieszczona jest plansza z tabelą porządkującą sole ze względu na rodzaj reakcji hydrolizy.
Polecenie: podane wzory soli przyporządkuj do odpowiedniej grupy uzasadniając swój wybór odpowiednimi równaniami rekcji hydrolizy.
Hydrolizie ulegają: - sole mocnych kwasów i słabych zasad, wykazując odczyn kwasowy;
- sole słabych kwasów i mocnych zasad, wykazując odczyn zasadowy;
- sole słabych kwasów i słabych zasad, wykazując odczyn obojętny.
Reakcja hydrolizy
- środki uprawy roślin
- lekarstwa na zgagę.
1.Określ, które z podanych soli ulegają hydrolizie, zapisz dla nich cząsteczkowe i jonowe równania reakcji hydrolizy:
2. Wyjaśnij, dlaczego podczas rozpuszczania w wodzie altacetu (leku stosowanego do przygotowywania okładów) następuje wytrącanie się kłaczkowatego osadu. Głównym składnikiem altacetu jest octan glinu.
(materiały do ćwiczeń uczniowskich)
(przykładowy foliogram)
mocny
elektrolit
|
Hydroliza soli
Hydrolizą nazywa sie ogólnie reakcję związku chemicznego z wodą, a szczególnym rodzajem reakcji hydrolizy jest odwracalny proces hydrolizy soli. Proces taki występuje w czasie rozpuszczania soli w wodzie. Produktami reakcji hydrolizy są; kwas i zasada.. W przypadku reakcji hydrolizy soli pochodzącej od kwasu jednowodorowego (HA) i jednowodorotlenowej zasady (MeOH), reakcję hydrolizy można zapisać schematycznie.
Me+ + A- + H2O <=> MeOH + HA
Reakcją odwrotną do reakcji hydrolizy jest reakcja zobojętnienia.
Nie wszystkie sole ulegają reakcji hydrolizy. Solami które nie ulegają reakcji hydrolizy są sole mocnych kwasów i mocnych zasad (NaCl, KNO3, K2SO4,...). Hydrolizują natomiast:
sole słabych jednoprotonowych kwasów i mocnych jednowodorotlenowych zasad (CH3COOK, NaCN) - odczyn zasadowy.
Przebieg procesu hydrolizy dla CH3COOK przedstawia równanie.
CH3COO - + K+ + H2O <=> CH3COOH + K+ + OH-
Z równania widzimy, że jon potasowy nie uczestniczy w równowadze kwasowo-zasadowej, dlatego powyższe równanie możemy zapisać w postaci
CH3COO - + H2O <=> CH3COOH + OH-
Ten stan równowagi nazywany jest reakcją hydrolizy anionowej (zasadowej)
sole mocnych jednoprotonowych kwasów i słabych jednowodorotlenowych zasad (NH4NO3) - odczyn kwasowy
NH4+ + H2O <=> NH3 + H3O+
Jon NO3- nie uczestniczy w równowadze kwasowo-zasadowej. Ten stan równowagi nazywany jest reakcją hydrolizy kationowej (kwasowej)
sole słabych jednoprotonowych kwasów i słabych jednowodorotlenowych zasad. Przykładem jest HCOONH4 - odczyn może być obojętny, kwasowy lub zasadowy, zależnie od wartości stałych dysocjacji odpowiednich kwasów i zasad
sole słabych dwuprotonowych kwasów i mocnych jednowodorotlenowych zasad. Przykładem jest K2S - odczyn zasadowy
sole trójprotonowych kwasów i mocnych jednowodorotlenowych zasad. Przykładem jest Na3PO4 - odczyn zasadowy, Na2HPO4 - odczyn zasadowy, NaH2PO4 - odczyn kwaśny
Na3PO4 (zasadowy)
PO43- + H2O <=> HPO42- + OH- i dalej
HPO42- + H2O <=> H2PO4- + OH-
H2PO4- + H2O <=> H3PO4 + OH-
Ostatnia reakcja praktycznie nie zachodzi, ponieważ nadmiar jonów wodorotlenowych przesuwa równowagę reakcji hydrolizy w lewo.
Na2HPO4 (zasadowy) - jony HPO42- dysocjują według równania
HPO42- + H2O <=> PO43- + H3O+
ale również hydrolizują;
HPO42- + H2O <=> H2PO4- + OH-
H2PO4- + H2O <=> H3PO4 + OH-
Ostatnia reakcja praktycznie nie zachodzi, ponieważ nadmiar jonów wodorotlenowych przesuwa równowagę reakcji hydrolizy w lewo.
NaH2PO4 (kwasowy)
H2PO4- + H2O <=> HPO42- + H3O+
W roztworze znajduje się pewien nadmiar jonów H3O+, stąd odczyn zasadowy
sole mocnych jednoprotonowych lub dwuprotonowych kwasów i słabych jednowodorotlenowych lub wielowodorotlenowych zasad. Przykładem jest MgCl2, AlCl3 - odczyn kwasowy
Zjawisko hydrolizy wyjaśnia doskonale wyjaśnia nam teoria Lowry'ego i Bronsteda. Zgodnie z tą teorią hydroliza sprowadza się bowiem do przejścia od kwasu do zasady. Przykładem jest hydroliza CH3COONa, którą możemy zapisać w postaci.
CH3COO- + HOH <=> CH3COOH + OH-
zasada1 kwas2 kwas1 zasada2
Fe(H2O)+3 + HOH <=> Fe(OH)(H2O)52+ + H3O+
kwas1 zasada2 zasada1 kwas2
W pierwszej reakcji proton od bardzo słabego kwasu H2O przechodzi do mocniejszej zasady CH3COO- tworząc słabo zdysocjowany kwas octowy oraz wolne jony wodorotlenowe. Roztwór ulega zalkalizowaniu.
W drugiej reakcji woda jest zasadą i odbiera proton od jednej z cząsteczek wody przy jonie żelaza (III).
Ponieważ powstaje silny kwas H3O+ oraz słaba zasada Fe(OH)(H2O)52+, roztór ulega zakwaszeniu.
Stężenie procentowe
Z Wikipedii
Stężenie procentowe to udział związków chemicznych w mieszaninach i roztworach wyrażony w procentach.
Pojęcie to oznacza najczęściej zawartość substancji rozproszonej lub rozpuszczonej w stosunku do całości mieszaniny lub roztworu, jednak czasami określa się w ten sposób również udział procentowy roztworu nienasyconego w stosunku do roztworu nasyconego (w tych samych warunkach termodynamicznych).
Pojęcie to nie jest tak jednoznaczne, jak w przypadku stężenia molowego, gdyż do jego obliczania można brać pod uwagę udziały wagowe lub objętościowe albo ich kombinację.
Klasyczne wagowe stężenie procentowe to liczba gramów związku, jaka jest obecna w 100 g roztworu, jednak w przypadków rozcieńczonych roztworów wodnych zazwyczaj stężenie procentowe oznacza w praktyce liczbę gramów związku chemicznego obecnego w 100 cm3 roztworu, gdyż przyjmuje się tu, że w przybliżeniu roztwory takie mają gęstość zbliżoną do wody - czyli 100 g/100 cm3. W przypadku bardziej stężonych roztworów nie jest to jednak już prawdą i gęstość takich roztworów może znacznie odbiegać od tej wartości.
Ze względu na to, że bardzo często gęstość roztworów nie jest zwykłą średnią gęstości jego składników (na skutek zachodzenia zjawiska zwanego kontrakcją objętości, np. w przypadku mieszania czystego etanolu z wodą), w praktyce laboratoryjnej i przemysłowej łatwiej jest stosować stężenie objętościowe oznaczające liczbę cm3 czystego związku, które zostało użyte do uzyskania 100 cm3 roztworu. Stężenia takie są stosowane zwłaszcza w przypadku mieszanin gazów oraz w przypadku napojów alkoholowych.
Procentowe stężenie wagowe jest zazwyczaj oznaczane w literaturze chemicznej symbolem "w/w" (weight/weight), objętościowe "v/v" (volume/volume) lub "s/s", zaś mieszane "w/s" lub "w/v".
Swoistym paradoksem stężenia procentowego roztworów jest to, że w niektórych przypadkach przyjmuje się roboczo, że wynosi ono więcej niż 100%. Przykładem tego jest m.in. oleum, czyli roztwór SO3 w kwasie siarkowym. W praktyce przemysłowej kwas siarkowy produkuje się poprzez nasycanie wody gazowym SO3. Po osiągnięciu 100% nasycenia uzyskuje się czysty, 100% kwas siarkowy, gdyż SO3 reaguje z wodą, prowadząc do powstania kwasu siarkowego. Dalsze nasycanie kwasu SO3 prowadzi do uzyskania roztworu SO3 w kwasie siarkowym. Tradycyjnie stężenie SO3 w takim układzie przelicza się tak, jakby to był ponad 100% roztwór kwasu siarkowego w wodzie. Np. oleum 120% to taki roztwór SO3 w kwasie siarkowym, który po dodaniu do niego 20% wody zamienia się w 100% kwas. Takie paradoksalne rozwiązanie, jakkolwiek sprzeczne ze zdrowym rozsądkiem, jest jednak często bardzo praktyczne i ułatwia obliczenia stechiometryczne.
Wzór:
gdzie:
Cp to stężenie procentowe [%]
ms to masa substancji rozpuszczanej [g]
mr to masa roztworu [g]
mrozp to masa rozpuszczalnika [g]
Stężenie molowe roztworów związków chemicznych to liczba moli danego związku jaką zawiera 1 dm3 danego roztworu.
Stężenie molowe jest równe stosunkowi liczby moli n substancji rozpuszczonej do objętości roztworu. Jednostką stężenia molowego w układzie SI jest mol/dm3. Określenie roztworu jako n-molowy oznacza, że jego stężenie molowe wynosi n mol/dm3. Stężenie molowe zależy od temperatury, gdyż objętość roztworu zmienia się wraz z temperaturą.
Wzór:
gdzie:
Cm = stężenie molowe
, co odpowiada
n = liczba moli związku chemicznego [mol]
Vr = objętość roztworu [dm3]
ms = masa substancji rozpuszczanej [g]
M = masa molowa substancji rozpuszczanej
Przyjęte jest zapisywanie jednostki
jako M. Do wyrażania niskich stężeń stosuje się też jednostki mM, μM, nM itp.
Enzymy - definicja i klasyfikacja
Enzymy - to katalizatory zmieniające szybkość reakcji chemicznej przez obniżenie energii swobodnej niezbędnej do zajścia reakcji, przy czym enzymy same nie ulegają zmianie w trakcie reakcji. W większości są to białka, jednak może być to również RNA o właściwościach katalitycznych - rybozym. W obecności enzymu szybkość reakcji może wzrosnąć nawet 107 razy. Reakcje katalizowane przez enzymy prawie zawsze przebiegają przy temperaturze niższej od 100 oC, ciśnieniu atmosferycznym i pH obojętnym.
Miejsce aktywne enzymu - jest regionem enzymu, który wiąże substrat i przemienia go w produkt. Jest to rodzaj trójwymiarowej przestrzeni w obrębie enzymu (zagłębienia) w którym tworzy się środowisko niepolarne co ułatwia wiązanie z substratem. Występują tam liczne słabe oddziaływania chemiczne, m.in. elektrostatyczne, hydrofobowe, Van der Wallsa, wodorowe oraz odwracalnie kowalencyjne.
Cykl katalityczny - szereg przemian chemicznych mających na celu zmianę substratu w produkt przy udziale enzymu. Można to przedstawić w następującym równaniu:
substrat + enzym ---> kompleks substrat-enzym ---> produkt + enzym
Modele obrazujące wiązanie substratu przez enzym:
model zamka i klucza (wg Fisher, z roku 1894) - zakłada, że każdorazowo w reakcji chemicznej dany enzym "pasuje" do substratu niczym zamek do klucza i możliwe jest połączeni tylko odpowiedniego enzymu z jemu przynależnym substratem. Ich kształty są sztywne i pasują jedynie po odpowiednim dopasowaniu.
model indukowanego dopasowania (wg Koshland, z roku 1958) - związanie substratu zachodzi na skutek indukowanej zmiany konformacji miejsca aktywnego. Inaczej mówiąc oddziaływanie substratu wymusza na enzymie taką zmianę konformacyjną miejsca aktywnego, że substrat łączy się z enzymem komplementarnie.
Specyficzność substratowa - specyficzność enzymu względem substratu, decydują o niej właściwości i ułożenie przestrzenne reszt aminokwasowych tworzących miejsce aktywne (co determinuje rodzaj przyłączanej cząsteczki).
Klasyfikacja enzymów:
1. oksydoreduktazy - przenoszą ładunki (elektrony i protony) z cząsteczki substratu na cząsteczkę akceptora: AH2 + B → A + BH2;
2. transferazy - przenoszą daną grupę funkcyjną (tiolową, aminową, itp.) z cząsteczki jednej substancji na cząsteczkę innej substancji: AB + C → A + BC;
3. hydrolazy - powodują rozpad substratu pod wpływem wody (hydroliza); do grupy tej należy wiele enzymów trawiennych: AB + H2O → A + B;
4. liazy - powodują rozpad substratu bez hydrolizy: AB → A + B;
5. izomerazy - zmieniają wzajemne położenie grup chemicznych bez rozkładu szkieletu związku: AB → BA;
6. ligazy - powodują syntezę różnych cząsteczek; powstają wiązania chemiczne: A + B → AB;
Enzymy - definicja i klasyfikacja
Enzymy - to katalizatory zmieniające szybkość reakcji chemicznej przez obniżenie energii swobodnej niezbędnej do zajścia reakcji, przy czym enzymy same nie ulegają zmianie w trakcie reakcji. W większości są to białka, jednak może być to również RNA o właściwościach katalitycznych - rybozym. W obecności enzymu szybkość reakcji może wzrosnąć nawet 107 razy. Reakcje katalizowane przez enzymy prawie zawsze przebiegają przy temperaturze niższej od 100 oC, ciśnieniu atmosferycznym i pH obojętnym.
Miejsce aktywne enzymu - jest regionem enzymu, który wiąże substrat i przemienia go w produkt. Jest to rodzaj trójwymiarowej przestrzeni w obrębie enzymu (zagłębienia) w którym tworzy się środowisko niepolarne co ułatwia wiązanie z substratem. Występują tam liczne słabe oddziaływania chemiczne, m.in. elektrostatyczne, hydrofobowe, Van der Wallsa, wodorowe oraz odwracalnie kowalencyjne.
Cykl katalityczny - szereg przemian chemicznych mających na celu zmianę substratu w produkt przy udziale enzymu. Można to przedstawić w następującym równaniu:
substrat + enzym ---> kompleks substrat-enzym ---> produkt + enzym
Modele obrazujące wiązanie substratu przez enzym:
model zamka i klucza (wg Fisher, z roku 1894) - zakłada, że każdorazowo w reakcji chemicznej dany enzym "pasuje" do substratu niczym zamek do klucza i możliwe jest połączeni tylko odpowiedniego enzymu z jemu przynależnym substratem. Ich kształty są sztywne i pasują jedynie po odpowiednim dopasowaniu.
model indukowanego dopasowania (wg Koshland, z roku 1958) - związanie substratu zachodzi na skutek indukowanej zmiany konformacji miejsca aktywnego. Inaczej mówiąc oddziaływanie substratu wymusza na enzymie taką zmianę konformacyjną miejsca aktywnego, że substrat łączy się z enzymem komplementarnie.
Specyficzność substratowa - specyficzność enzymu względem substratu, decydują o niej właściwości i ułożenie przestrzenne reszt aminokwasowych tworzących miejsce aktywne (co determinuje rodzaj przyłączanej cząsteczki).
Klasyfikacja enzymów:
1. oksydoreduktazy - przenoszą ładunki (elektrony i protony) z cząsteczki substratu na cząsteczkę akceptora: AH2 + B → A + BH2;
2. transferazy - przenoszą daną grupę funkcyjną (tiolową, aminową, itp.) z cząsteczki jednej substancji na cząsteczkę innej substancji: AB + C → A + BC;
3. hydrolazy - powodują rozpad substratu pod wpływem wody (hydroliza); do grupy tej należy wiele enzymów trawiennych: AB + H2O → A + B;
4. liazy - powodują rozpad substratu bez hydrolizy: AB → A + B;
5. izomerazy - zmieniają wzajemne położenie grup chemicznych bez rozkładu szkieletu związku: AB → BA;
6. ligazy - powodują syntezę różnych cząsteczek; powstają wiązania chemiczne: A + B → AB;
Chromatografia (gr. chromatos = barwa + grapho = pisze) to technika analityczna lub preparatywna służąca do rozdzielania lub badania składu mieszanin związków chemicznych. Wynalazcą tej techniki, opracowanej na początku XX wieku jest Michaił Cwiet
W każdej technice chromatograficznej najpierw rozdziela się badaną mieszaninę, a następnie przeprowadza się detekcję poszczególnych składników. Rozdział substancji następuje w wyniku przepuszczenia roztworu badanej mieszaniny przez specjalnie spreparowaną fazę rozdzielczą (złoże), zwaną też fazą stacjonarną. Fazą rozdzielczą są substancje wykazujące zdolności sorpcyjne lub zdolne do innych oddziaływań na substancje przepływające. Podczas przepływu eluenta (fazy ruchomej) przez fazę rozdzielczą następuje proces wymywania zaadsorbowanych (lub związanych) substancji. Intensywność tego procesu jest różna dla poszczególnych składników mieszaniny. Jedne składniki są więc zatrzymywane w fazie dłużej, a inne krócej, dzięki czemu może następować ich separacja. Czas przebywania danego składnika w kolumnie określany jest mianem czasu retencji.
W zależności od rodzaju eluentu czyli substancji w której rozpuszcza się badaną mieszaninę rozróżnia się następujące techniki chromatograficzne:
chromatografia cieczowa - w której eluentem jest ciekły rozpuszczalnik lub mieszanina rozpuszczalników
chromatografia gazowa - w której eluentem jest gaz (zwykle hel, argon lub wodór, czasem azot).
chromatografia nadkrytyczna - w której eluentem jest gaz w stanie nadkrytycznym.
W zależności od rodzaju i sposobu przygotowania fazy rozdzielczej:
TLC - thin layer chromatography, chromatografia cienkowarstwowa - w której fazę rozdzielczą stanowi cienka warstwa fazy stałej naniesiona na sztywną płytkę. Na tak spreparowaną płytkę nanosi się próbkę roztworu, po czym na skutek działania sił kapilarnych, grawitacji lub pola elektrycznego następuje przepływ i rozdział mieszaniny;
chromatografia bibułowa - w której fazę rozdzielczą stanowi pasek lub arkusz bibuły filtracyjnej lub specjalnego typu bibuły chromatograficznej;
chromatografia kolumnowa - w której faza rozdzielcza jest umieszczona w specjalnej kolumnie, przez którą przepuszcza się następnie roztwór badanej mieszaniny. Przepływ roztworu przez kolumnę można wymuszać grawitacyjnie lub stosując różnicę ciśnień na wlocie i wylocie kolumny;
chromatografia powinowactwa - w której odpowiednio spreparowana faza rozdzielcza jest zdolna do oddziaływań chemicznych o zmiennym powinowactwie wobec rozdzielanych substancji;
chromatografia jonowymienna - w której substancje oddziałują ze złożem za pomocą oddziaływań jonowych.
W zależności od parametrów procesu:
HPLC - high performance/pressure liquid chromatography, wysokosprawna/ciśnieniowa chromatografia cieczowa - odmiana cieczowej chromatografii kolumnowej z użyciem eluentu pod wysokim ciśnieniem;
FPLC - fast protein/performance liquid chromatography - szybka, białkowa/szybkosprawna chromatografia cieczowa - odmiana HPLC działająca na niższych ciśnieniach, stosująca prócz złóż sorpcyjnych, także zwykłe złoża typu sit molekularnych, służąca głównie do rozdziału białek i polipeptydów. Opatentowana i wyłączna nazwa dla firmy Pharmacia;
UPLC - ultra performance liquid chromatography, ultrasprawna chromatografia cieczowa - odmiana cieczowej chromatografii kolumnowej. Działa na wyższych ciśnieniach i mniejszych przepływach, a kolumny mają mniejsze ziarno (1,7 - 1,8 μm). Pozwala uzyskiwać krótsze czasy retencji i wyższe rozdzielczości. Opatentowana i wyłączna nazwa dla firmy Waters.
GPC - Gel Permeation Chromatography - chromatografia żelowa - odmiana kolumnowej chromatografii cieczowej. Polega na rozdziale składników mieszaniny na sitach molekularnych ze względu na ich wielkość (masę). Stosowana m.in. do określania średnich mas cząsteczkowych polimerów
Wyszukiwarka
Podobne podstrony:
biochemia plan zasady
Biochemia 4, kwasy karboksylowe, metanol: CH3-OH, etanol: C2H5-OH, Propyl: C3H7-OH, Butanol: C4H9-OH
biochenia kwasy nukleinowe
KWASY NUKLEINOWE, Ogrodnictwo UP Lbn, Biochemia, kwasy nukl
biochem kwasy nukleinowe, BIOCHEMIA
Zasady wg Cz.Czapówa i O.Lipkowskiego, Pedagogika Resocjalizacyjna
sprawko biochemia kwasy nukleinowe, Biochemia, BIOCHEMIA Z DC++
Zasada heterocykliczna, Ogrodnictwo UP Lbn, Biochemia, kwasy nukl
Biochemia Kwasy zolciowe2
biochem (4), I KWASY NUKLEINOWE
biochem (3), I KWASY NUKLEINOWE
10 BIOCHEMIA kwasy nukleinowe
biochemia plan zasady
Ludzkie pryncypia zasady wg buddyzmu ezoterycznego
W08s-Slabe kwasy i zasady wieloprotonowe, chemia, szkolka
kwasy i zasady
więcej podobnych podstron