GRUPA NR: ZESPÓŁ: |
ĆWICZENIE NR: 7
Współczynnik podziału Nernsta. Sprawozdanie zbiorcze.
|
DATA WYKONANIA ĆWICZENIA:
|
ZESPÓŁ: |
|
OCENA:
|
1. WSTĘP TEORETYCZNY:
Rozważając układ izotermiczno - izobaryczny złożony z dwóch praktycznie niemieszających się cieczy 1 i 2 otrzymujemy układ 2 - fazowy ciekły, a wytworzone fazy nazwać można fazą I i II.
Faza I jest nasyconym roztworem składnika 2 w 1, faza II jest nasyconym roztworem składnika 1 w 2. Wprowadzając do jednej z tych faz substancję 3 (słaby kwas organiczny) rozpocznie się proces przenoszenia przez granicę faz substancji 3. Proces ten będzie trwał do chwili ustalenia się równowagi termodynamicznej. Zgodnie z zasadą termodynamiki dla układów wielofazowych w stanie równowagi potencjały chemiczne składnika 3 muszą być jednakowe dla obu faz.
![]()
- standardowe potencjały chemiczne składnika 3 w fazach I i II,
a zatem:
![]()
- ![]()
-odpowiednia aktywność składnika 3 w fazach I i II
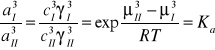
Stan standardowy wybrano tak, że współczynniki aktywności są równe jedności w roztworach nieskończenie rozcieńczonych.
Dla realnych stężeń określa się tzw. współczynnik podziału Nernsta wyrażany przy pomocy stężeń:
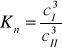
Współczynnik podziału Nernsta jest to stosunek stężeń składnika występującego w obu fazach w postaci cząsteczek jednego typu.
Tak zdefiniowany współczynnik podziału zmienia się ze stężeniem, dlatego, że roztwory nie są doskonałe.
W szczególnym przypadku składnik 3 jest w fazie I częściowo zdysocjowany, a w fazie II częściowo zasocjowany.
2. CEL.
Analiza wyników poszczególnych cząstkowych sprawozdań zespołów.
3. OPRACOWANIE DANYCH DOŚWIADCZALNYCH:
Zespół 1 |
Zespół 2 |
Zespół 3 |
Zespół 4 |
||||
α |
CII/CI |
α |
CII/CI |
α |
CII/CI |
α |
CII/CI |
0,1069 |
3,1800 |
0,091 |
3,914 |
0,1124 |
3,4000 |
0,1187 |
2,1500 |
0,0855 |
4,3375 |
0,075 |
5,990 |
0,1470 |
5,5600 |
0,1022 |
3,2364 |
0,0768 |
5,4800 |
0,063 |
6,407 |
0,1663 |
6,9158 |
0,0912 |
4,2286 |
0,0704 |
6,2500 |
0,059 |
7,312 |
0,1795 |
7,5182 |
0,0855 |
5,1750 |
KN |
KDim |
KN |
KDim |
KN |
KDim |
KN |
KDim |
0,884 |
183,99 |
0,363 |
20,689 |
1,067 |
416,95 |
1,389 |
838,639 |
Dla układu trójskładnikowego dwufazowego kwas benzoesowy - woda - ksylen można zapisać równanie łączące charakterystyczne wielkości zadane i szukane:
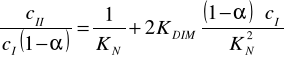
Jest to zarazem równanie prostej y = a x + b, jeżeli przyjmie się następujące założenia:
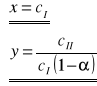
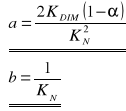
W związku z tym można obliczyć wartości dwóch stałych charakterystycznych:
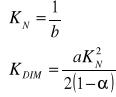
Należy jeszcze określić metodą regresji liniowej współczynniki prostej, a i b:
Zespół 1 |
Zespół 2 |
Zespół 3 |
Zespół 4 |
||||
C1 |
|
C1 |
|
C1 |
|
C1 |
|
0,0050 |
3,5333 |
0,0070 |
4,349 |
0,0045 |
3,8250 |
0,0040 |
2,4571 |
0,0080 |
4,7534 |
0,0105 |
6,484 |
0,0075 |
6,5156 |
0,0055 |
3,6327 |
0,0100 |
5,9619 |
0,0150 |
6,864 |
0,0095 |
8,2125 |
0,0070 |
4,6250 |
0,0120 |
6,7567 |
0,0170 |
7,768 |
0,0110 |
9,1889 |
0,0080 |
5,6712 |
Stałe wynoszą odpowiednio:
![]()
![]()
4. WNIOSKI.
Woda i ksylen są wzajemnie nierozpuszczalne i po zmieszaniu tworzą dwie warstwy ciekłe, będące praktycznie czystymi cieczami. Do tego układu dodajemy stały kwas benzoesowy, rozpuszczalny w obu cieczach. Pojawił się on w obu warstwach tworzących roztwory o różnych stężeniach. Stosunek stężenia kwasu benzoesowego w warstwie organicznej do warstwy wodnej nie jest stały i jest liczbą większą od jedności. Oznacza to, że stężenie kwasu w warstwie ksylenowej jest większe niż w warstwie wodnej. Kwas benzoesowy dużo lepiej rozpuszcza się w warstwie organicznej niż w wodnej.
Stała dimeryzacji jest wysoka, ponieważ w warstwie organicznej powstaje więcej cząsteczek zdimeryzowanych niż monomerów.
Stała podziału Nernsta jest mniejsza od 1 co świadczy, że udziały składnika niezdysocjowanego w fazie wodnej i niezasocjowanego w fazie organicznej są w przybliżeniu sobie równe, jednak więcej monomerów jest w fazie organicznej.
Dodatkowym wnioskiem, który można wyciągnąć z tego doświadczenia jest to, że ze wzrostem stężenia stopień dysocjacji rośnie.
Wyszukiwarka
Podobne podstrony:
Współczynnik podziału Nernsta
29. Wyznaczanie współczynnika podziału Nernsta metodą potencjometryczną, chemia fizyczna
29 Wyznaczanie współczynnika podziału Nernsta metodą potenc
29 Wyznaczanie współczynnika podziału Nernsta metodą potencjometryczną
wspolczynnik podzialu nernsta
Współczynnik podziału Nernsta
Współczynnik podziału nernsta
Współczynnik podziału Nernsta
cwiczenie nr 5 wyznaczanie wspolczynnika podzialu prawo Nernsta
cwiczenie nr 5 wyznaczanie wspolczynnika podzialu prawo Nernsta2
cwiczenie nr 5 wyznaczanie wspolczynnika podzialu prawo Nernsta1
cwiczenie nr 5 wyznaczanie wspolczynnika podzialu prawo Nernsta
Sprawozdania Karol, Współczynnik podziału, Gr
lab 7 - współczynnik podziału słabego kwasu pomiędzy fazą wodną a organiczną, kiciaqq
Wspolczynnik podzialu, Farmacja, II rok farmacji, I semstr, fizyczna, Fizyczna, Sprawozdania z fizyc
Współczynnik podziału Sprawozdanie
Sprawozdania z fizycznej 1 ~$rawozdanie Współczynnik podziału
10 Współczynnik podziałuid 11179
chem.fiz.współ.podziału Nernsta, Inżynieria środowiska, inż, Semestr III, Chemia fizyczna, laborator
więcej podobnych podstron