2 Opracowanie wyników
Obliczam współczynnik podziału jodku pomiędzy toluenem i wodą;
K=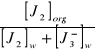
= ![]()
Ai = 0,351 wartość absorbancji wyjściowego roztworu J2 w toluenie
A2i = absorbancja kolejnych roztworów o różnych stężeniach.
1) K1 = ![]()
= 0,76
2 ) K2= 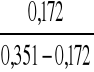
= 0,96
3 ) K3 = ![]()
= 1,07
4 ) K4 = ![]()
= 1,47
5 ) K5 = ![]()
= 2,51
Z wykresu zależności A2i = f(CkJ), wyznaczam wartość A2o metodą ekstrapolacji A2o=limA2i
Wartość A2o = 0,1611
Współczynnik korelacji wynosi 0,9776 co świadczy o zależności liniowej.
Nachylona wynosi a = - 0,1299
Odcięta wynosi b = 0,2809
y = a x + b
y = - 0,1299x + 0,2809
Następnie obliczam współczynnik K, który mówi o zależności pomiędzy absorbancją roztworu J2 w fazie organicznej w równowadze z nasyconym roztworem J2 w wodzie.
K=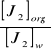
= ![]()
![]()
K=![]()
= ![]()
= 4
K=4
Widzimy, że absorbancja roztworu J2 w fazie organicznej ma wyższą wartość od wartości nasyconego roztworu J2 w wodzie, dlatego widzimy J2 w fazie organicznej w przewadze.
Obliczam wartość
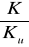
-1
1) ![]()
= 4,26
2) ![]()
= 3,17
3) ![]()
= 2,74
4) ![]()
= 1,72
5) ![]()
= 0,59
Wyniki pomiarów i obliczeń zestawiam w tabelce.
L.p. |
Stężenie KJ |
A2i |
Kli |
K/Kli - 1 |
1 |
1 |
0,151 |
0,76 |
4,26 |
2 |
0,9 |
0,172 |
0,96 |
3,17 |
3 |
0,7 |
0,181 |
1,07 |
2,74 |
4 |
0,5 |
0,209 |
1,47 |
1,72 |
5 |
0,3 |
0,251 |
2,51 |
0,59 |
Narysować zależność(![]()
-1) od stężenia KJ.
Współczynnik korelacji wynosi 0,9529 co świadczy o zależności liniowej.
Wartość nachylenia, wynosi a=3,8136
Z założenia, że wartość odciętej wynosi 0 (b=0)
y = ax
y = 3,8136x
Ponieważ zależność (K/Kli -1) od stężenia KJ jest funkcją linową jej współczynnik liniowy jest liczbowo równy stałej równowagi reakcji Kc. Dla potwierdzenia obliczam Kc metodą najmniejszych kwadratów.
0bliczam stałą równowagi reakcji Kc obliczaną metodą najmniejszych kwadratów
.
L.p. |
x |
y |
x 2 |
x * y |
y 2 |
x + y |
(x+y) 2 |
1 |
1 |
4,26 |
1,00 |
4,26 |
18,15 |
5,46 |
29,81 |
2 |
0,9 |
3,17 |
0,81 |
2,85 |
10,05 |
4,07 |
16,56 |
3 |
0,7 |
2,74 |
0,49 |
1,92 |
7,51 |
3,44 |
11,83 |
4 |
0,5 |
1,72 |
0,25 |
0,86 |
2,96 |
2,22 |
4,93 |
5 |
0,3 |
0,59 |
0,09 |
0,18 |
0,35 |
0,89 |
0,79 |
suma |
3,4 |
10,68 |
2,64 |
10,07 |
187,70 |
16,08 |
63,92 |
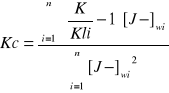
![]()
Kc=3,81
3.Wnioski
Stała równowagi reakcji, Kc wyrażona stosunkiem iloczynu stężeń produktów do iloczynu stężeń substratów reakcji odwracalnej w stanie równowagi wynosi: Kc= 3,81
Stałą podziału K reakcji obliczyłem wykorzystując różnice podziału jodu pomiędzy rozpuszczalnikiem organicznym i wodą oraz Prawo Nenrsta - prawo równowagi fazowej.
W moim doświadczeniu wynosi K= 4
Z wykonanych pomiarów łatwo możemy zaobserwować zależność stężenia KJ i absorbancji. Przy stężeniu 0,3 mol/dm3 związku KJ z dodanym roztworem jodku w toluenie absorbancja jest najwyższa i wynosi 0,251. Przy wzroście stężenia np. 0,7 mol/dm3 zauważamy zmniejszenie absorbancji do 0,181. Widzimy, że ze wzrostem stężenia maleje absorbancja roztworu i że jest to zależność ta jest liniowa. Co więcej zależność ta jest zgodna z prawem Lamberta-Beera (przyp. absorbancja jest wprost proporcjonalna do stężenia c substancji absorbującej). Natomiast absorbancja wyjściowego roztworu J2 w toluenie wynosi 0,351 i ma najwyższą wartość.
Na drugim wykresie dotyczącym zależności (K/Kli -1) od stężenia KJ, widzimy że przy zwiększaniu się stężenia wzrasta wartość(K/Kli -1) , jest to również zależność liniowa.
Pomiary mogą być obarczone pewnym błędem spowodowanym niewłaściwym i trudnym odczytaniem wartości absorbancji.
1
Wyszukiwarka
Podobne podstrony:
Ćwiczenie nr 35, studia, Budownctwo, Semestr II, fizyka, Fizyka laborki, Fizyka - Labolatoria, Ćwicz
Ćwiczenie nr 35
CWICZENIE 1, Politechnika Wrocławska- Wydział Chemiczny (W3), miernictwo i automatyka, Skrypt (analo
Ćwiczenie nr 35, laboratorium fizyczne, Laboratorium semestr 2 RÓŻNE
Ćwiczenie nr 35, studia, Budownctwo, Semestr II, fizyka, Fizyka laborki, Fizyka - Labolatoria, Ćwicz
Ćwiczenie nr 35
Ćwiczenie nr 35
Ćwiczenie nr 3, Technologia chemiczna, Projekt technologiczny, Projekty, fwd pd , projekt technologi
cwiczenie nr 1 2011 10 02 13 35 22
Ćw nr 35, Ćwiczenie 35, Laboraka
Ćwiczenie nr 8 [1, inżynieria chemiczna i procesowa, semestr II, fizyka, laborki, 8. ćwiczenie
Sprawozdania z fizycznej 1, Równowaga chemiczna nr 6, Ćwiczenie nr 6: Równowaga chemiczna
procesy ćwiczenie nr 5, Technologia chemiczna, 5 semestr, Podstawowe procesy przemysłu chemicznego i
Ćwiczenia nr 6 (2) prezentacja
cwiczenie nr 7F
cwiczenie nr 2
Ćwiczenie nr 4
cwiczenia nr 5 Pan Pietrasinski Nieznany
więcej podobnych podstron