mgr inż. Andrzej Radomski
Materiały wybuchowe inicjujące
Spis treści
Podstawowe wiadomości
Zasady bezpieczeństwa
Historia
Pioruniany kwas piorunowy; piorunian rtęci, otrzymywanie, właściwości, produkcja; inne pioruniany; sole oksymów.
Azydki nieorganiczne kwas azotowodorowy; azydek ołowiu, właściwości, produkcja; azydek srebra, miedzi, innych metali, amonu.
Azydki organiczne triazydotrinitrobenzen; triazydek cyjanuru.
Związki diazowe i pokrewne diazodinitrofenol; tetrazen.
Sole nitrofenoli trinitrorezorcynian ołowiu; dinitrorezorcynian ołowiu, pikrynian ołowiu, sól potasowa dinitrobenzofuroksanu.
Sole zespolone
Nadtlenki nadtlenek acetonu; nadtlenek urotropiny.
Acetylen i jego sole acetylenek miedzi, srebra.
Podstawowe wiadomości
Materiały wybuchowe inicjujące stosuje się w celu pobudzenia do detonacji kruszących materiałów wybuchowych. Wymagania:
mały impuls inicjujący potrzebny do zapoczątkowania rozkładu,
łatwość przejścia od palenia do detonacji,
bezpieczeństwo produkcji materiału i wyrobów,
łatwość napełniania i zaprasowywania,
trwałość w temperaturze pokojowej i podwyższonej,
niekorozyjność wobec metali stosowanych w wyrobach,
nie jest wymagana duża siła wybuchu ani duża prędkość detonacji.
MW inicjujące produkowane są metodami periodycznymi ze względu na stosunkowo nieduże zapotrzebowanie (tonażowo).
Ważniejsze grupy materiałów inicjujących:
pioruniany metali ciężkich,
azydki metali ciężkich,
azydki organiczne,
sole nitrofenoli i metali ciężkich,
acetylenki metali ciężkich,
związki azowe, diazowe i pochodne,
nadtlenki organiczne,
mieszaniny inicjujące.
Impuls inicjujący - wywołuje szybką reakcję chemiczną, która powinna objąć obszar materiału wystarczający do powstania fali uderzeniowej. Rodzaje:
mechaniczne (uderzenie, tarcie),
cieplne (bezpośredni płomień, ogrzewanie),
złożone (wybuch ładunku pomocniczego, iskra elektryczna, wybuch elektryczny).
Zasady bezpieczeństwa
Przy produkcji operuje się niewielkimi ilościami materiałów inicjujących (co najwyżej kilka kilogramów).
Przy wytwarzaniu nie dopuszczać do powstawania dużych kryształów (naprężenia), jak również kryształów o kształcie igieł (łatwe pękanie).
Unikać należy warunków sprzyjających powstawaniu ładunków elektrostatycznych (uziemienie, nieiskrzące materiały, podłogi gumoprzewodzące, odpowiednia wilgotność
W miarę możliwości należy eliminować obecność ludzi przy produkcji i przetwórstwie. Czynności szczególnie niebezpieczne (zasypywanie, prasowanie) powinny być wykonywane zdalnie z sąsiedniego pomieszczenia lub przynajmniej zza zasłony.
Konieczne jest likwidowanie wszelkich resztek materiału inicjującego w aparaturze (reaktorach, osadnikach) przy użyciu środków chemicznych rozkładających związek.
Wytworzonych materiałów w zasadzie nie wolno przewozić. W obrębie zakładu produkującego wyroby z MW inicjujących transport w stanie sflegmatyzowanym (np. wilgotny).
Nie wolno przechowywać MW inicjujących razem z kruszącymi.
Przy syntezie nowych materiałów o potencjalnych właściwościach inicjujących należy rozpoczynać od najmniejszej skali i powiększać ją dopiero po uzyskaniu informacji o właściwościach wybuchowych materiału.
Historia
początek XVII w. pierwsze wzmianki, Basilius Valentinus - „złoto wybuchowe” (sól zespolona powstała przez rozpuszczanie tlenku złota w amoniaku)
1630 holender van Drebbel - „rtęć piorunująca”
1690 Kunkel - opis otrzymania „rtęci piorunującej”
1799-1800 Howard - opisany został piorunian rtęci
1805 Forsyth - masy uderzeniowe na bazie chloranu potasu
ok. 1815 Bellot, Egg i inni - spłonki z masą zapałową w miedzianej lub mosiężnej łusce
1823 Wright - spłonka zapalająca z piorunianem rtęci
Liebig - ustalenie składu elementarnego piorunianu rtęci
1831 Bickford - lont wolnopalący się (z oplotem) zamiast stopiny
1867 Nobel - przez zwiększenie ładunku piorunianu rtęci otrzymano spłonkę detonującą
1891 Curtius - otrzymanie azydku ołowiu
1892 Will i Lenz - propozycja zastosowania azydków metali ciężkich
1894 Nef - ustalenie budowy piorunianu rtęci
1909 Wöhler - mechanizm reakcji otrzymywania piorunianu rtęci
1910 Hoffman i Roth - otrzymanie tetrazenu
1925 Rathsburg - zastosowanie tetrazenu w technice wybuchowej
1955 Patinkin, Horwitz i Lieber - zaproponowanie struktury tetrazenu
Pioruniany
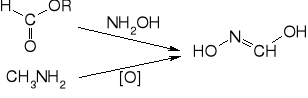
Kwas piorunowy HONC - izomeryczny z kwasem cyjanowym HCNO i izocyjanowym HNCO; analogiczne kwasy tiocyjanowy HCNS i azotowodorowy HNNN. Hydroliza kwasu piorunowego prowadzi do kwasu mrówkowego i hydroksyloaminy. Może przyłączać chlorowodór, dając chloroformoksym.
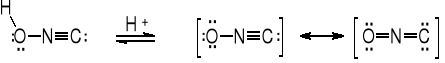
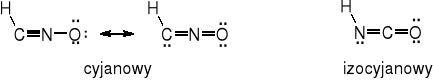
Piorunian rtęci otrzymuje się w wyniku reakcji alkoholu etylowego z roztworem azotanu rtęci w kwasie azotowym. Powszechnie akceptowany mechanizm reakcji składa się z następujących etapów:
1. utlenianie etanolu do aldehydu octowego
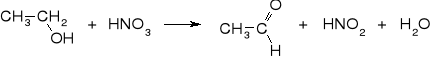
2. nitrowanie do aldehydu nitrozooctowego
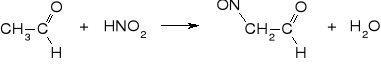
3. izomeryzacja do aldehydu izonitrozooctowego
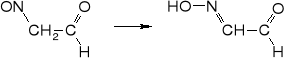
4. utlenienie do kwasu izonitrozooctowego
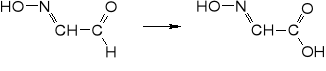
5. nitrowanie do kwasu nitrolooctowego
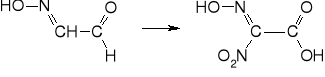
6. dekarboksylacja do kwasu metylonitrolowego
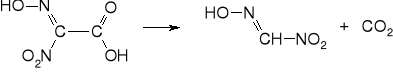
7. rozkład do kwasu piorunowego
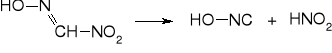
8. strącenie piorunianu rtęci
![]()
Jako produkty uboczne powstają lotne związki: azotan i azotyn etylu, nitroetan, aldehyd octowy, tlenki azotu i CO2. W roztworze pozostaje jeszcze kwas szczawiowy. Produkt może zawierać niewielkie domieszki azotanu i szczawianu rtęciowego.
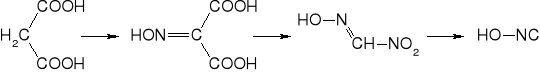
Inne metody prowadzące do otrzymania piorunianu rtęci to reakcja kwasu malonowego z azotanem rtęci w kwasie azotowym wobec azotynu sodu lub rozkład soli rtęciowej nitrometanu.
Kryształy piorunianu rtęci mają kształt oktaedryczny w układzie jednoskośnym. Mogą mieć barwę szarą, lekko brązową lub białą, co nie świadczy o czystości produktu. Biały produkt otrzymuje się wobec niewielkiej ilości kwasu solnego lub soli miedzi, a także gdy zastąpić alkohol etylowy aldehydem octowym. Barwa nie pochodzi od wolnej rtęci, co było niegdyś sugerowane, a prawdopodobnie od produktów polimeryzacji kwasu piorunowego. W produkcie białym barwa jest maskowana przez inne domieszki. Wolna rtęć może pojawić się w produkcie na skutek rozkładu fotochemicznego lub termicznego.
Właściwości fizykochemiczne i chemiczne.
Gęstość krystaliczna piorunianu rtęci wynosi 4,40÷4,42 g/cm3, niektórzy autorzy sugerują, że po krystalizacji gęstość maleje do 4,32÷4,39 g/cm3.
Gęstość usypowa wynosi 1,22÷1,60 g/cm3, większa dla produktu grubokrystalicznego.
Rozpuszczalność w wodzie bardzo słaba (na 100g wody 0,07g/12°, 0,176g/49°, 0,77g/100°), nieco lepsza w alkoholu. Bardzo dobra w stężonym amoniaku (w 30-35° 4-krotną ilość), ale w 60° następuje rozkład. Wytrącić piorunian można odparowując amoniak, rozcieńczając wodą lub dodając kwasu. Piorunian rozpuszcza się w roztworze cyjanków (wytrącenie rozcieńczonym kwasem azotowym), dobrze rozpuszcza się w pirydynie (po rozcieńczeniu wodą wytrąca się addukt, który można rozłożyć przez suszenie) oraz etanoloaminie (wytrącenie produktu o wysokiej czystości następuje po rozcieńczeniu wodą lub zakwaszeniu). We wszystkich przypadkach zbytnie podwyższenie temperatury powoduje rozkład piorunianu.
Piorunian rtęci jest względnie odporny na działanie rozcieńczonych kwasów, zwłaszcza azotowego, stężone kwasy natomiast powodują jego rozkład (w kontakcie ze stężonym kwasem siarkowym wybucha), podobnie jak silne alkalia. Szybki rozkład przebiega pod wpływem siarczku amonu. Piorunian rozpuszcza się z rozkładem w roztworze tiosiarczanu sodu, co wykorzystywane jest do niszczenia resztek i odpadów. Można także wykorzystać tę reakcję do oznaczania ilościowego (zanieczyszczenia pozostają nierozpuszczone).
Hg(ONC)2 + 2 Na2S2O3 + 2 H2O → HgS4O6 + (CN)2 + 4 NaOH
lub Hg(ONC)2 + 2 Na2S2O3 + H2O → HgS4O6 + NaCN + NaNCO + 2 NaOH
Piorunian rtęci reaguje z większością metali w rozmaitych warunkach (energiczniej w obecności wody i w podwyższonej temperaturze), tworząc odpowiednie pioruniany lub produkty ich rozkładu oraz wydzielając rtęć (także korodującą metale).
Odporność termiczna piorunianu rtęci jest najmniejsza ze stosowanych materiałów inicjujących, zwłaszcza że rozkład zachodzi ze wzrastającą szybkością. Zauważalny rozkład zachodzi już w 50°. Światło słoneczne powoduje dość szybki rozkład z wydzieleniem gazów.
Hg(OCN)2 → Hg + N2 + 2 CO
Temperatura pobudzenia wynosi odpowiednio:
przy ogrzewaniu 5°/min. 160÷165°
przy szybkim ogrzewaniu 187÷190°
na płycie po 5 sek. 215°
na płycie natychmiast 277°
W celu uzyskania odpowiedniej gęstości piorunian rtęci poddaje się zaprasowaniu pod ciśnieniem 250÷350 atm. Prasowanie z zastosowaniem wyższego ciśnienia pozwala uzyskać większe gęstości, lecz powyżej 1600 atm. następuje zaprasowanie „na martwo”, co powoduje trudne zapalenie i brak skłonności do przejścia w detonację. Już pod ciśnieniem 500 atm. można zaobserwować kilka procent niepełnych wybuchów spłonki.
Wrażliwość na nakłucie rośnie ze wzrostem ciśnienia prasowania do 700÷750 atm. po czym maleje aż do zaniku przy 2000 atm. Prędkość detonacji piorunianu rtęci może wynosić od 2250 do 6500 m/s i zależy od średnicy ładunku i gęstości, np. 3500 m/s dla d 2,0 g/cm3 i 4200 m/s dla d 3,0 g/cm3.
Wrażliwość na tarcie i uderzenie jest wysoka. Wartości podawane różnią się, ale czułość jest większa niż nitrogliceryny. Meyer podaje 1-2 Nm. Dodatek wody lub innych substancji obojętnych (olej, parafina) znieczula piorunian. Dla małych ładunków dodatek 10% wody powoduje rozkład bez wybuchu, a przy 30% wody w ogóle nie ulega rozkładowi.
Inne parametry:
Entalpia tworzenia +941kJ/kg
Ciepło wybuchu 1486 kJ/kg
Bilans tlenowy -11,2% (licząc do Hg)
-16,9% (licząc do HgO)
Zawartość azotu 9,84%
Objętość gazów 311 dm3/kg
Wydęcie w bloku 130 cm3 (37-50% TNT)
Zdolność pobudzająca nie jest najwyższa, zazwyczaj stosuje się w połączeniu z pentrytem, heksogenem lub tetrylem. Ilość gramów potrzebna do pobudzenia TNT wynosi 0,25-0,36; tetrylu 0,20-0,29; RDX 0,19; PETN 0,17.
Toksyczność jest niewielka ze względu na nierozpuszczalność piorunianu. Zatrucie jest typowe dla rtęci i jej związków.
Produkcja piorunianu rtęci prowadzona może być na wiele sposobów, różniących się jedynie szczegółami. Jednorazowa szarża nie przekracza zazwyczaj 0,5kg produktu. Ze względu na reaktywność kwasu azotowego i samej rtęci reakcję prowadzi się w reaktorach szklanych. Typowy przykład to:
1. rozpuszczenie rtęci ok. 10-krotnej ilości kwasu azotowego (zazwyczaj dzień wcześniej),
2. wylanie otrzymanego roztworu do 7-9-krotnej ilości (w stosunku do rtęci) alkoholu etylowego o stężeniu 87-96%, po kilkunastu minutach rozpoczyna się gwałtowna reakcja z wrzeniem roztworu i wydzielaniem białych oparów, przy czym wydzielają się kryształy piorunianu rtęci w postaci szarych igieł,
3. po zakończeniu reakcji mieszaninę chłodzi się, rozcieńcza wodą i dekantuje znad kryształów,
4. produkt przenosi się na płócienny filtr i przemywa do zaniku kwasu azotowego,
5. piorunian frakcjonuje się pod względem wielkości kryształów, mniejsze można użyć bezpośrednio, większe poddaje się rozdrabnianiu pod wodą,
6. gotowy materiał przechowuje się w stanie mokrym (50% wody) w woreczkach płóciennych.
Najczęstsze modyfikacje powyższego procesu polegają na:
- ogrzanie roztworu rtęci w kwasie azotowym przed wylaniem do alkoholu,
- ogrzanie alkoholu przed reakcją,
- dodawanie zimnego alkoholu w czasie reakcji w celu złagodzenia jej przebiegu, zbyt duża jego ilość może jednak spowodować powstawanie produktu zanieczyszczonego rtęcią,
- dodanie do alkoholu przed reakcją niewielkiej ilości roztworu miedzi w kwasie solnym lub samego kwasu solnego, dzięki czemu uzyskuje się produkt barwy białej.
Piorunian rtęci w stanie wilgotnym może być transportowany i używany bezpośrednio do produkcji wyrobów metodą „mokrą”. W innym przypadku przed zastosowaniem należy go wysuszyć. Zazwyczaj stosuje się suszarnie z naturalnym lub wymuszonym ruchem powietrza, czasem z urządzeniami do przesiewania rozłożonego materiału. W temperaturze 45-50° suszenie trwa ok. 8h, w 65-70° 1÷1,5h. Suchy piorunian jest zsypywany przy pomocy urządzeń typu wstrząsarek do pojemników z tworzyw sztucznych. Proces odbywa się bez udziału pracowników.
Po procesie produkcyjnym pozostaje ciecz poreakcyjna i szlam z przemywania piorunianu, zawierające niewielkie ilości związków rtęci, które można odzyskiwać. Skroplone pary znad roztworu są trujące, można z nich oddestylować znad stałego NaOH alkohol, który może być powtórnie użyty. Resztki i odpady piorunianu niszczy się rozpuszczając w roztworze tiosiarczanu sodu.
Inne pioruniany
Inne metale również tworzą pioruniany, otrzymywane zazwyczaj z piorunianu rtęci przez działanie czystym metalem lub amalgamatem. Silniejsze własności wybuchowe i inicjujące mają pioruniany srebra, kadmu i miedzi, jednak są znacznie droższe. Jedynie piorunian srebra znalazł zastosowanie we Włoszech. Otrzymywany jest analogicznie z roztworu azotanu srebra w kwasie azotowym i alkoholu.
Związki analogiczne - sole oksymów
Analogiczne w budowie do kwasu piorunowego (oksym tlenku węgla). Wiele związków wykazuje właściwości inicjujące. Kwas metylonitrolowy (nitroformoksym) można otrzymać z nitrometanu i kwasu azotawego, a kwas formylohydroksamowy z hydroksyloaminy i estrów kwasu mrówkowego lub przez utlenianie metyloaminy. Oba związki tworzą z metalami, zwłaszcza ciężkimi sole wybuchowe.
![]()
Azydki nieorganiczne
Kwas azotowodorowy HN3 jest bezbarwną cieczą o tt. -80° i tw. 37°. Ma ostry, drażniący zapach i silnie zaznaczone właściwości trujące (na poziomie HCN), podobnie jak azydki. Nie obserwuje się efektu kumulowania trucizny z organizmie.
Hybryda rezonansowa azydków kowalencyjnych odpowiada wiązaniom rzędu 1,5 między atomami azotu i oraz 2,5 między atomami i γ. W azydkach jonowych występują dwa wiązania podwójne. Zgadza się to z długościami i siłą wiązań.
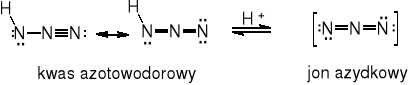
Kwas azotowodorowy jest kwasem o mocy zbliżonej do octowego. Rozpuszcza metale wydzielając wodór, choć część zwykle ulega redukcji do amoniaku. Dzięki właściwościom utleniającym rozpuszcza także miedź, srebro i rtęć:
2 Ag + 3 HN3 → 2 AgN3 + N2 + NH3
W mieszaninie z kwasem solnym rozpuszcza nawet złoto i platynę (jak woda królewska):
2 Au + 3 HN3 + 6 HCl → 2 AuCl3 + 3 N2 + 3 NH3
Z kolei działa redukująco na nadmanganian potasu i kwas azotawy.
Jest trwały w roztworach wodnych. Czysty w stanie ciekłym jest bardzo niebezpieczny. Zamknięty wybucha w temperaturze 100°. Znane są przypadki eksplozji podczas gwałtownego oziębienia i sączenia pod próżnią Rozkłada się pod wpływem UV na wodór, azot i amoniak.
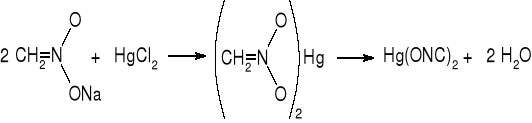
Synteza kwasu azotowodorowego i jego soli:
Wolny kwas azotowodorowy można otrzymać w reakcji hydrazyny z kwasem azotawym:
NH2-NH2 + HO-NO → HN3 + 2 H2O
Bardziej bezpieczna jest reakcja hydrazyny z estrami kwasu azotawego, w której powstają od razu sole. Stosowana jest np. reakcja z azotynem amylu i metanolanem sodu:
NH2NH2 + C5H11ONO + CH3ONa → NaN3 + C5H11OH + CH3OH + H2O
Obecnie w skali przemysłowej najczęściej stosowana jest reakcja podtlenku azotu ze stopionym amidkiem sodowym:
NaNH2 + N2O → NaN3 + H2O
NaNH2 + H2O → NH3 + NaOH
sumarycznie 2 NaNH2 + N2O → NaN3 + NH3 + NaOH
Azydek ołowiu
Najważniejszy obecnie materiał inicjujący Pb(N3)2, otrzymywany z roztworów azydku sodu i azotanu ołowiu. Tworzy bezbarwne kryształy o gęstości 4,797 g/cm3. Gęstość usypowa wynosi ok. 1,2 g/cm3. Występuje w dwóch odmianach: - stabilniejszej, wytrącającej się przy szybkim mieszaniu i - powstającej podczas powolnej dyfuzji roztworów. Obecnie stwierdzono istnienie jeszcze odmian γ i δ.
Rozpuszcza się słabo w wodzie, lepiej w stężonym roztworze azotanu sodu, a zwłaszcza octanu sodu (w 18° odpowiednio 0,023 g, 0,125 g i1,542 g w 100 cm3 roztworu). Rozpuszczalność charakteryzuje się dużą zależnością temperaturową, umożliwiającą krystalizację azydku ołowiu. W praktyce nie krystalizuje się go ze względu na liczne przypadki wybuchów. Bardzo dobrym rozpuszczalnikiem jest etanoloamina - 100 g rozpuszcza 146 g azydku.
Azydek ołowiu ulega powolnemu rozkładowi w obecności tlenu z powietrza (zwłaszcza w obecności dwutlenku węgla) do kwasu azotowodorowego, azotu i amoniaku. Również światło powoduje rozkład, który jednak zatrzymuje się na powierzchniowej warstwie materiału i nie powoduje istotnej zmiany właściwości wybuchowych.
Azydek ołowiu rozpuszcza się z całkowitym rozkładem w rozcieńczonym kwasie azotowym lub octowym, zawierającym azotyn sodu. Stosuje się 15% HNO3 i 8% NaNO2. Reakcja ta jest wykorzystywana do niszczenia resztek i odpadów azydku ołowiu, obecność azydku sprawdza się roztworem chlorku żelaza, dającym z jonami azydkowymi czerwone zabarwienie
3 Pb(N3)2 + 2 HNO2 + 6 HNO3 → 3 Pb(NO3)2 + 10 N2 + 4 H2O
Azydek ołowiu może w długim czasie reagować z miedzią i jej stopami, tworząc azydek miedziowy, wyjątkowo wrażliwy na tarcie. Dlatego azydek ołowiu zaprasowuje się wyłącznie do łusek aluminiowych (można jednak umieścić w łusce miedzianej tulejkę ze stopu ZnAl z zaprasowanym azydkiem).
Trwałość termiczna azydku ołowiu jest wyjątkowo duża. Temperatura pobudzenia wynosi 327÷360°, zależnie od szybkości grzania. Natychmiastowy wybuch na płycie metalowej następuję przy 380°. Związana z tym jest trudna zapalność azydku ołowiu, zarówno od iskry jak i bezpośredniego płomienia. Dlatego często azydek miesza się z trinitrorezorcynianem ołowiu lub pokrywa się jego warstwą.
Wrażliwość azydku ołowiu na uderzenie jest mniejsza niż piorunianu rtęci, ale źródła znacznie różnią się co do jej wartości. Większą natomiast wykazuje wrażliwość na tarcie, co jest przyczyną licznych wypadków z azydkiem ołowiu. Szczególnie niebezpieczne są duże kryształy, zwłaszcza w postaci igieł. Naprężenia prowadzące do pękania są uznawane za najczęstszą przyczynę wybuchów podczas takich operacji jak przesypywanie, suszenie czy prasowanie. Ważne jest, aby w produkcie nie występowały kryształy o rozmiarach większych niż 0,1 mm. Istotne jest dodawanie w procesie produkcyjnym dekstryny, która ułatwia wytwarzania małych, równomiernych kryształów, a także zmniejsza wrażliwość azydku ołowiu na tarcie.
Azydek ołowiu detonuje bardzo łatwo, nawet w obrębie pojedynczych kryształów. Z tym wiąże się duża skuteczność inicjująca (0,07 g dla TNT i 0,025 g dla tetrylu). Łatwość przejścia od palenia do detonacji potwierdza też mały wpływ wilgoci na czułość azydku ołowiu, nawet 30% wody praktycznie go nie znieczula. Prędkość detonacji jest dość duża i wynosi np. 4500 m/s przy d 3,8 g/cm3 lub 5300 m/s przy d 4,6 g/cm3.
Azydek ołowiu prasuje się pod ciśnieniem 500-600 atm., ale nawet 2000 atm. nie zaprasowuje go „na martwo”.
Inne parametry:
Entalpia tworzenia +1420kJ/kg
Ciepło wybuchu 1540 kJ/kg
Bilans tlenowy 0% (licząc do Pb)
-5,5% (licząc do PbO)
Zawartość azotu 28,85%
Objętość gazów 308 dm3/kg
Wydęcie w bloku 110 cm3 /10 g
Produkcja azydku ołowiu
Reakcję prowadzi się periodycznie w reaktorze ze stali kwasoodpornej zaopatrzonym w płaszcz grzejny i mieszadło. Kolejność operacji jest następująca:
1. W reaktorze umieszcza się 9-10% roztwór azotanu ołowiawego, ogrzewa do 50° i doprowadza do pH ok. 4 (ze względu na hydrolizę jonów ołowiawych) dodając NaOH.
2. Do roztworu Pb(NO3)2 dodaje się niewielką ilość dekstryny w wodzie.
3. Przygotowuje się 2,7-3% roztwór stechiometrycznej ilości azydku sodu o odczynie alkalicznym (hydroliza jonów azydkowych).
4. Roztwór azydku sodu wlewa się powoli do reaktora, mieszając i utrzymując temperaturę.
5. Po zakończonej reakcji wyciąga się do góry mieszadło i dekantuje znad osadu azydku ołowiu.
6. Osad przenosi się strumieniem wody na filtr i płucze dużą ilością wody.
Istnieje kilka odmian azydku ołowiu produkowanego na świecie, różniących się warunkami procesu, a także dodatkami, jak dekstryna.
Koloidalny azydek ołowiu - produkowany z niewielkiego nadmiaru azotanu ołowiu, szczególnie wrażliwy na bodźce elektryczne.
Brytyjski „Service” - otrzymywany z octanu ołowiu z dodatkiem węglanu sodu, pokryty węglanem ołowiu jest całkowicie niehigroskopijny.
Brytyjski RD 1333, RD 1343 i amerykański specjalnego przeznaczenia (SPLA) - otrzymywany z octanu ołowiu w obecności karboksylometylocelulozy zamiast dekstryny, o większej czułości i mniej higroskopijny.
PVA - z dodatkiem alkoholu poliwinylowego, o lepszych zdolnościach inicjujących, większej gęstości i wrażliwości na płomień.
GAM - z dodatkiem żelatyny, bezpieczniejszy w operowaniu.
Sferoidalny dekstrynowany - z dodatkiem środka powierzchniowo czynnego
W przypadku stwierdzenia nieprawidłowego kształtu lub rozmiaru kryształów całą partię niszczy się roztworem kwasu azotowego i azotynu sodu.
Transport azydku ołowiu między pomieszczeniami odbywa się w pojemnikach bakelitowych. Suszenie prowadzi się w suszarni z obiegiem powietrza w temperaturze 65-70°.
Azydek srebra
AgN3 - otrzymywany tą samą metodą co ołowiu. Ma nieco lepsze zdolności inicjujące. Temperatura pobudzenia (273°) jest znacznie niższa, ale dużo mniejsza czułość na uderzenie. Stosowany rzadko ze względu na wyższą cenę.
Azydek miedziowy
Cu(N3)2 - brunatny (bezwodny). Występuje też w odmianach zielonej (szarej), czarnej oraz żółtej (sól zasadowa). Nie ma żadnego zastosowania, ale jest ważny ze względu na możliwość powstawania z azydku ołowiu w kontakcie ze stopami miedzi. Temperatura pobudzenia 202-205°, prędkość detonacji 5000-5500 m/s, bardzo wysoka zdolność inicjująca (0,4 mg pobudza PETN). Ekstremalnie wysoka wrażliwość na tarcie, a nawet dotknięcie.
Może tworzyć sole zespolone, również o właściwościach inicjujących, np. [Cu(NH3)4](N3)2.
Azydki innych metali
Nie mają praktycznego znaczenia, w większości wybuchowe. Mają niższą odporność termiczną (150-200°) i mniejszą wrażliwość na uderzenie (z wyjątkiem miedziawego, CuN3). Azydki cynku i kadmu wykazują bardzo dużą odporność na uderzenie i również temperaturę (ok. 290°). Azydki wapniowców palą się gwałtownie (wapnia może detonować). Azydek sodu pali się, lecz nie jest uważany za materiał wybuchowy.
Azydek amonu
NH4N3 - ciekawy ze względu na dużą ilość produktów gazowych (1148 dm3/kg) i niską temperaturę wybuchu (1350-1400°). Nie znalazł zastosowania w paliwach rakietowych ze względu na dużą lotność.
Azydki organiczne
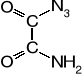
Większość azydków organicznych jest zdolna do wybuchu, lecz ze względu na małą trwałość nie znajdują zastosowania jako materiały wybuchowe. Najmniejszą trwałość wykazują azydki acylowe, np. amidoazydek kwasu szczawiowego wykazuje właściwości inicjujące, ale rozkłada się z wybuchem już w 115°. Diazydek kwasu węglowego z kolei wybucha już od dotknięcia.
Nieco większą trwałość wykazują azydki aromatyczne, choć znane są liczne przypadki wybuchów podczas pracy z nimi. Azydki alifatyczne są zwykle dość trwałe i można je np. destylować. Można orientacyjnie przyjąć, że możliwość wybuchu występuje gdy stosunek (C+O)/N jest mniejszy niż 3, o ile nie występują w cząsteczce inne ugrupowania eksplozoforowe. Mogą być silnymi materiałami wybuchowymi, jak azotan 2-azydoetanolu, o właściwościach podobnych do nitrogliceryny, większej wrażliwości na uderzenie i temperaturze pobudzenia w zamkniętym naczyniu 190°.
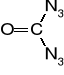
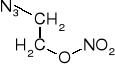
Triazydotrinitrobenzen
Otrzymany w 1931 r. Nierozpuszczalny w wodzie, niehigroskopijny i niekorozyjny wobec stopów żelaza i miedzi. Topi się w 131° z rozkładem do benzotrisfuroksanu (heksanitrozobenzenu). Rozkład zachodzi również w niższych temperaturach. Nie znalazł zastosowania z uwagi na małą trwałość chemiczną.
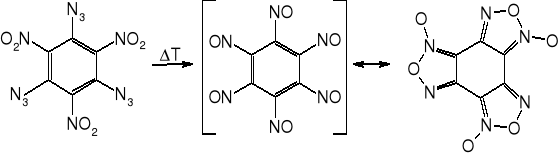
Mniej wrażliwy na tarcie i uderzenie od piorunianu rtęci. Silny materiał wybuchowy, między tetrylem a pentrytem. Wydęcie w bloku Trauzla 500 cm3. Prędkość detonacji 7500 m/s przy d 1,54 g/cm3. Gęstość krystaliczna 1,8054 g/cm3. Ciśnienie powyżej 300 atm może zaprasować na martwo. Bardzo dobre zdolności inicjujące: 0,02 g dla trotylu i 0,01 g dla tetrylu.
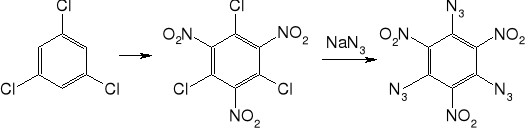
Otrzymywany z 1,3,5-trichlorobenzenu przez nitrowanie i następnie podstawienie chloru azydkiem sodu w środowisku wodno-alkoholowym. Po wytrąceniu przemywa się i suszy w niewysokiej temperaturze. Można krystalizować z chloroformu.
Triazydek cyjanuru
Związek heterocykliczny, nierozpuszczalny w wodzie, słabo w zimnym alkoholu, dobrze w alkoholu na gorąco i rozpuszczalnikach organicznych. Lekko higroskopijny, drażniący dla skóry.
Silny materiał inicjujący - 0,1 g dla TNT i 0,04 g dla tetrylu. Prędkość detonacji 5545 m/s dla d 1,15 g/cm3. Temperatura pobudzenia 205-208° (20°/min.), powolny rozkład już powyżej 100°. Nie może być stosowany z powodu zbyt dużej wrażliwości na uderzenie i tarcie. Częste są przypadku wybuchu w czasie operacji technologicznych, zwłaszcza suszenia i prasowania. Duże kryształy mogą wybuchnąć od niewielkiego nacisku.
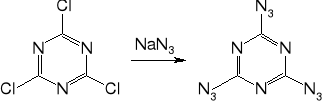
Otrzymywany w reakcji chlorku cyjanuru (trimer chlorocyjanu) z wodnym roztworem azydku sodu.
Związki diazowe i pokrewne
Diazodinitrofenol
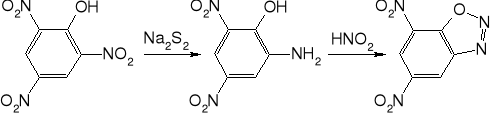
DDNP, Dinol. Jedyny związek diazowy o praktycznym znaczeniu. Otrzymywany przez diazowanie kwasu pikraminowego. Żółte kryształy o gęstości 1,63 g/cm3. Rozpuszcza się w rozpuszczalnikach organicznych, a także w stężonym kwasie solnym i octowym, słabo w wodzie. Jest odporny na działanie kwasów, natomiast rozcieńczone zasady powodują rozkład z wydzieleniem azotu. Reakcja ta jest wykorzystywana do niszczenia resztek.
Rozkłada się w 177° bez topnienia. Na płycie wybucha po 10 s w 180°, po 5 s w 185°, natychmiast 203°. W 50° wytrzymuje bez zmiany 30 mies. suchy i 12 mies. pod wodą. Jest dość odporny na działanie światła. Wykazuje nieco mniejszą wrażliwość na uderzenie niż piorunian rtęci lub trinitrorezorcynian ołowiu. Co ciekawe, produkt drobnokrystaliczny wykazują większą (!) wrażliwość niż grubokrystaliczny.
Dzięki dużej objętości gazów (876 dm3/kg) jest silnym materiałem wybuchowym. Prędkość detonacji wynosi 6600 m/s przy d 1,5 g/cm3. Jako materiał inicjujący jest nieco słabszy od azydku ołowiu, choć silniejszy niż piorunian rtęci.
Ważnym problemem jest postać krystaliczna DDNP. W postaci igieł gęstość usypowa to zaledwie 0,27 g/cm3, po zaprasowaniu pod ciśnieniem 240 atm 0,86 g/cm3. Dodatkową wadą jest trudne zasypywanie do tulejek. Kryształy w postaci płytek mają gęstość usypową 0,80-0,82 g/cm3. Dużą zaletą diazodinitrofenolu jest możliwość prasowania, nie ulega zaprasowaniu na martwo nawet pod ciśnieniem 9000 atm.
DDNP otrzymuje się z kwasu pikraminowego, którego synteza z kwasu pikrynowego jest pierwszym etapem produkcji. Roztwór części kwasu pikrynowego w rozcieńczonym NaOH ogrzewa się do 45-50° i silnie mieszając dodaje część przesączonego roztworu siarczku sodu. Następnie dodaje się stopniowo i równomiernie stały kwas pikrynowy i roztwór siarczku (10% nadmiar), utrzymując temperaturę poniżej 65°, aby uniknąć reakcji ubocznych. Pozostawia się do następnego dnia, osad soli sodowej kwasu pikraminowego odsącza się, przemywa 10% roztworem NaCl i wodą. Produktu nie suszy się, lecz używa do dalszej produkcji w stanie wilgotnym.
Produkcję DDNP prowadzi się w lekko podwyższonej temperaturze (25-45°), co umożliwia uzyskanie produktu o dobrej postaci krystalicznej. W temperaturze 15° powstaje produkt iglasty. Do zawiesiny wodnej soli sodowej kwasu pikraminowego dodaje się roztwór azotynu sodu w niewielkim nadmiarze. Do mieszaniny wkrapla się powoli 5,5% kwas solny. Koniec reakcji sprawdza się papierkiem jodoskrobiowym. Produkt sączy się, przemywa zimną wodą i suszy w temperaturze 35-40° w ciemności. Proponuje się także dodawanie do roztworu barwników trifenylometanowych dla zapewnienia odpowiedniej postaci kryształów.
Tetrazen
Pełna nazwa hydrat 1-(5-tetrazolylo)-4-guanylo-tetrazenu. Białe lub żółtawe, drobne kryształy, o gęstości krystalicznej 1,7 g/cm3, usypowej ok. 0,45 g/cm3. Praktycznie nierozpuszczalny w wodzie i większości rozpuszczalników organicznych. Na zimno odporny na działanie wody, na gorąco zachodzi hydroliza z wydzieleniem azotu (2 mole na mol tetrazenu). Rozkłada się pod wpływem zasad, co można wykorzystać do niszczenia resztek. Raczej odporny na działanie rozcieńczonych kwasów, ze stężonymi tworzy sole (rozpuszcza się).
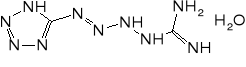
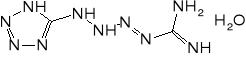
Mechanizm reakcji prowadzących do otrzymania jest wciąż dyskutowany. Prawdopodobnie przebieg przez następujące etapy:
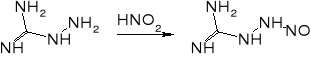
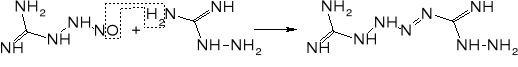
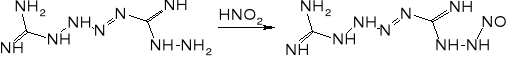
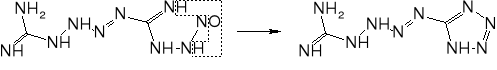
Ważnym problemem podczas produkcji tetrazenu jest unikanie nadmiaru kwasów. Obecność kwasu siarkowego (i innych kwasów nieorganicznych) może prowadzić do powstawania azydoguanidyny, która z kolei w środowisku lekko kwaśnym lub lekko zasadowym może ulegać przegrupowaniu do aminotetrazolu. Związek ten był proponowany jako składnik prochów bezdymnych, a także może być ligandem w solach kompleksowych o własnościach inicjujących. W obecności nadmiaru kwasu octowego może powstawać obok tetrazenu ditetrazylotriazyna.
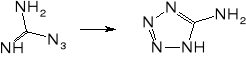
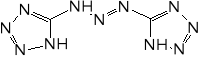
Tetrazen jest wystarczająco trwały w temperaturze poniżej 75°. W 100° ulega wyraźnemu rozkładowi. Na płycie wybucha po 5 s w temperaturze 160°. Ogrzewany z szybkością 20°/min. wybucha już w 140°. Wrażliwość na uderzenie podobna lub nieco większa niż piorunianu rtęci. Zdolność inicjująca gorsza od piorunianu rtęci i tetrazen nie znajduje zastosowania w spłonkach detonujących. Przy małych gęstościach łatwo przechodzi od palenia w detonację, jednak po zaprasowaniu zdolność ta bardzo szybko maleje, choć nadal może być zdetonowany impulsem pobudzającym (spłonką).
Pierwszym etapem produkcji jest redukcja nitroguanidyny pyłem cynkowym w warunkach pH 7,0-7,5 i temperaturze poniżej 15°. Powstałą aminoguanidynę w postaci siarczanu wykorzystuje się do syntezy tetrazenu.
50 l roztworu zawierającego 4 kg azotynu sodu ogrzewa się do temperatury 50-55°. Mieszając wprowadza się 40 l roztworu zawierającego 5 kg siarczanu aminoguanidyny. Szybkość dodawania roztworu ma zasadnicze znaczenie dla wielkości powstających kryształów - im mniejsza, tym większy jest ich rozmiar. Czasem stosuje się dodatek dekstryny, co pozwala na uzyskanie bardziej jednorodnych kryształów.
Osad tetrazenu dekantuje się kilkakrotnie, przenosi strumieniem wody na filtr i przemywa wodą i na koniec alkoholem. Usunięcie wody obecnej na powierzchni kryształów zapobiega ich sklejaniu podczas suszenia. Tetrazen suszy się w temperaturze 45-55°. Resztki tetrazenu w instalacji niszczy się, hydrolizując parą wodną.
Sole nitrofenoli
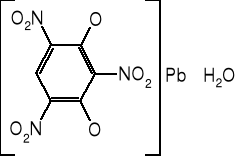
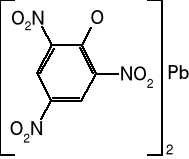
Trinitrorezorcynian ołowiu
Inaczej styfninian ołowiu, w przemyśle spotykana także jest nazwa tricynat (z niemieckiego - trizinat). Krystalizuje jako monohydrat, który w sposób odwracalny można odwodnić przez wygrzewanie. Kryształy ciemnożółte do brunatnoczerwonego. Gęstość krystaliczna 3,1 g/cm3, usypowa 1,0-1,6 g/cm3. Niehigroskopijny, nierozpuszczalny w wodzie i większości rozpuszczalników organicznych. Rozpuszcza się nieco w roztworze octanu amonu, dobrze zaś w formamidzie. Trinitrorezorcynian ołowiu wykazuje dobrą trwałość chemiczną i termiczną. Jest niereaktywny wobec metali. Ulega rozkładowi pod wpływem kwasów i zasad.
Wrażliwość na uderzenie jest nieduża - porównywalna do azydku ołowiu, obecność wody krystalizacyjnej ją zwiększa. Temperatura pobudzenia wynosi 267-268°. Wyjątkowo łatwo następuje pobudzenie przez bezpośrednie działanie płomienia lub iskry elektrycznej. Ma to ogromne znaczenie dla bezpieczeństwa produkcji, zwłaszcza że trinitrorezorcynian ołowiu w stanie suchym łatwo elektryzuje się. Stosuje się uziemienie urządzeń, zapewnia odpowiednią wilgotność powietrza, czasem nawet jego jonizację.
Słaby materiał wybuchowy. Szybkość detonacji wynosi 2100 m/s przy gęstości 0,93 g/cm3 i 5200 m/s przy gęstości 2,9 g/cm3. Zdolność pobudzająca jest tak mała, że trinitrorezorcynian ołowiu nie może być stosowany jako samodzielny materiał inicjujący. Stosowany jest natomiast w spłonkach zapalających, jako składnik mas niekorodujących. Stosowany jest także jako dodatek do azydku ołowiu zwiększający jego wrażliwość na płomień, a także w postaci zaprasowanej warstwy zabezpieczającej azydek ołowiu przed działaniem CO2 z powietrza.
Otrzymywany jako produkt reakcji trinitrorezorcynianu sodu lub magnezu i azotanu ołowiu. Do reaktora wprowadza się zawiesinę trinitrorezorcyny w wodzie i dodaje stałego tlenku magnezu. Powstający trinitrorezorcynian magnezu przechodzi do roztworu, który ogrzewa się wskutek reakcji. Roztwór sączy się i pozostawia do odstania. Klarowną ciecz ogrzewa się do 60° i mieszając dodaje 34% roztwór azotanu ołowiu, utrzymując temperaturę. Po reakcji szybko schładza się do temperatury 25° i pozostawia do opadnięcia osadu. Produkt dekantuje się, przenosi na filtr i przemywa wodą. Trinitrorezorcynian ołowiu suszy się w temperaturze 65-70° i przesiewa. Bardzo ważnym zagadnieniem jest utrzymanie odpowiednich warunków reakcji, takich jak temperatura, pH, szybkość dodawania składników. W przypadku niezachowania właściwych parametrów może dojść do powstawania zasadowego trinitrorezorcynianu ołowiu, który ma dużo gorsze właściwości użytkowe.
Resztki i odpadki niszczy się dodając do zawiesiny wodnej roztwór Na2CO3 - strąca się z zawiesiny węglan ołowiu. Następnie zakwasza się kwasem siarkowym i redukuje opiłkami żelaza wolną trinitrorezorcynę.
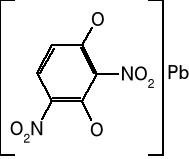
Dinitrorezorcynian ołowiu
Otrzymywany w reakcji dinitrorezorcynianu sodu i azotanu ołowiu na gorąco i wytrącany przez ochłodzenie. Ma słabsze właściwości inicjujące. Wykazuje mniejszą wrażliwość na uderzenie i tarcie, stąd jest bezpieczniejszy w użyciu. Łatwo zapala się od płomienia. Stosowany czasem do mas zapałowych.
Pikrynian ołowiu
Jeden z pierwszych otrzymanych materiałów inicjujących . Jego użycie na dużą skalę wyklucza bardzo wysoka wrażliwość na bodźce mechaniczne. Stosowany w czasie II wojny światowej przez Niemców. Otrzymywany w reakcji azotanu ołowiu z kwasem pikrynowym w roztworze, w temperaturze 6-10°. Produkt przemywany alkoholem z dodatkiem roztworu azotanu ołowiu, zapobiegającym rozpuszczaniu produktu i suszony.
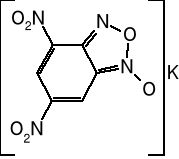
Sól potasowa dinitrobenzofuroksanu KDNBF
Czerwone kryształy o gęstości 2,21 g/cm3. Zauważalnie rozpuszczalny w zimnej wodzie. Lekko higroskopijny. Dobra odporność termiczna. Temperatura pobudzenia 210°. Wrażliwość pośrednia między piorunianem rtęci i azydkiem ołowiu. Dość silny materiał wybuchowy (93% TNT w bloku Trauzla). Znajduje zastosowanie w mieszaninach inicjujących.
Sole zespolone
Pierwszymi zbadanymi solami zespolonymi o właściwościach wybuchowych (oprócz złota i srebra „piorunującego”) były chlorany aminometali, np. [Cu(NH3)4](ClO3)2. Zaobserwowano zdolność inicjującą, jednak na przeszkodzie zastosowania stała zbyt mała trwałość kompleksów. Trwalsze okazały się chlorany hydrazynometali, np. [Ni(N2H4)3](ClO3)2 lub [Cd(N2H4)3](ClO3)2. Są to bardzo silne materiały inicjujące, jednocześnie o bardzo dużej wrażliwości. Nieco słabsze okazały się zasadowe nadchlorany hydrazynometali - jednak silniejsze od piorunianu rtęci.
Proponowane do praktycznego zastosowania były także azotany hydrazynometali, o dobrej trwałości: [Ni(N2H4)3](NO3)2, [Co(N2H4)3](NO3)2, [Cd(N2H4)3](NO3)2, o temperaturach deflagracji odpowiednio 215°, 210° i 245°. Sól niklu - NHN wykazuję siłę wybuchu (w bloku Trauzla) równą ok. 85% wartości kwasu pikrynowego. Detonuje w plastikowej tulejce o średnicy 8 mm z szybkością 2900-3100 m/s. Azotany są stosunkowo bezpieczne w użyciu ze względu na małą wrażliwość. Wadą ich jest trudność pobudzenia.
Otrzymywanie soli zespolonych na ogół polega na wytrącaniu ich ze zmieszanych roztworów soli prostej i ligandu. Warunki zależą od rodzaju metalu, anionu i ligandów i często wymagają dużej staranności wykonania.
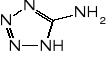
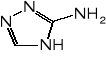
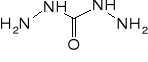
Nowsze sole zespolone, badane jako potencjalne materiały inicjujące zawierają obok metalu anion dinitroaminy (ADN - HN(NO2)2) oraz szereg ligandów o dużej zawartości azotu, np. aminotetrazol, aminotriazol, karbahydrazyd.
Nadtlenki
Większość nadtlenków organicznych ma właściwości wybuchowe, wiele z nich także inicjujące. Nie znalazły zastosowania ze względu na zbyt dużą wrażliwość i jednocześnie małą trwałość. Te cechy są przyczyną niebezpieczeństw związanych z możliwością powstawania nadtlenków, np. z eterów, przy destylacji których należy zachować szczególną ostrożność.
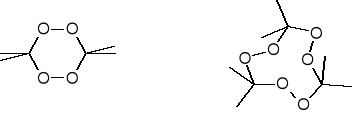
Nadtlenek acetonu (w postaci dimeru lub trimeru) można otrzymać działaniem nadsiarczanu potasu lub nadtlenku wodoru na aceton w obecności kwasu siarkowego. Ma wyraźnie zaznaczone właściwości inicjujące. Charakteryzuje się dużą prężnością par - łatwo sublimuje, co wyklucza jego zastosowanie.
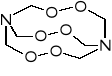
Nadtlenek heksametylenodiaminy (HMTD) może być otrzymana z urotropiny i nadtlenku wodoru w obecności kwasu cytrynowego w temperaturze poniżej 0°. Białe kryształy praktycznie nierozpuszczalne w wodzie i większości rozpuszczalników organicznych. W temperaturze 75° rozkłada się wyraźnie z wydzieleniem metyloaminy. Gorąca woda rozkłada go całkowicie. Gęstość krystaliczna 1,57 g/cm3, ale usypowa tylko 0,66 g/cm3. Nie ulega zaprasowaniu na martwo pod ciśnieniem 730 atm.
Na płycie w temperaturze 200° wybucha natychmiast, w 149° po 3 s. Wrażliwość na uderzenie ma nieco mniejszą niż piorunian rtęci. Jest silnym materiałem wybuchowym. Przy gęstości 0,88 g/cm3 detonuje z szybkością 4510 m/s (przy średnicy 5,5 mm). Ma również dobrą zdolność inicjującą - znacznie większą niż piorunian rtęci. Nie znalazł praktycznego zastosowania ze względu na niewystarczającą trwałość.
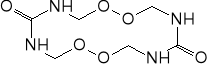
Tetrametylenodiperoksydodikarbamid - otrzymany w wyniku reakcji nadtlenku wodoru z roztworem mocznika w formalinie, w obecności kwasu azotowego. Zbyt mała trwałość i zbyt duża wrażliwość.
Acetylen i jego sole
Powszechnie znana jest zdolność acetylenu do wybuchu pod wpływem sprężenia. W temperaturze pokojowej wybucha sprężony adiabatycznie do ciśnienia 170 atm. W wyższej temperaturze potrzebne jest mniejsze ciśnienie. Dzięki dodatniej entalpii tworzenia wykazuje duże ciepło wybuchu - mimo braku tlenu w cząsteczce. W stanie stałym nie wybucha od uderzenia, lecz może być pobudzony spłonką. Sole metali ciężkich mają właściwości inicjujące.
Acetylenek miedziawy, Cu2C2 jest ciałem stałym barwy rudej lub czerwonobrązowej, nierozpuszczalnym w wodzie i większości rozpuszczalników organicznych. Rozkłada się pod wpływem ogrzewania w kwasie solnym. Także roztwór cyjanku potasu lub perhydrol powodują rozkład. Do temperatury 100° wykazuje dobrą trwałość. Wybucha na powietrzu w temperaturze 120-123°. Acetylenek miedziawy otrzymuje się przepuszczając acetylen przez amoniakalny roztwór chlorku miedziawego. Ważne jest uniknięcie powstawania acetylenku miedziowego - CuC2 (czarny lub brunatny), który wybucha już w 50-70° i jest bardziej wrażliwy na bodźce mechaniczne. W tym celu można stosować dodatek substancji redukujących jak hydroksyloamina lub hydrazyna. Ze względu na łatwość zapłonu i silny płomień znajduje zastosowanie w masach zapałowych w zapalnikach elektrycznych.
Acetylenek srebra, Ag2C2 - biały lub lekko szary proszek. Silniejsze właściwości wybuchowe niż acetylenek miedziowy. Temperatura pobudzenia 200°. Powstaje w wyniku przepuszczania acetylenu przez amoniakalny roztwór chlorku srebra. Bez praktycznego zastosowania.
Zastosowanie najważniejszych materiałów inicjujących
materiał |
płomień |
uderzenie |
tarcie |
wł. inic. |
typowe zastosowanie |
azydek ołowiu |
+ |
++ |
+++ |
+++ |
spłonki detonujące |
diazodinitrofenol |
++ |
+ |
+ |
+++ |
spłonki zapalające; spłonki pobudzające |
piorunian rtęci |
++ |
+++ |
++ |
++ |
spłonki zapalające z KClO3 i Sb2S3; zapalniki i spłonki pobudzające, nakłuciowe i uderzeniowe; dawniej lont detonujący |
trinitrorezorcynian ołowiu |
+++ |
++ |
++ |
+ |
dodatek zwiększający wrażliwość Pb(N3)2 na płomień; mieszaniny niekorodujące; spłonki zapalające; zapłonniki elektryczne |
tetrazen |
++ |
+++ |
++ |
+ |
spłonki zapalające, uderzeniowe; dodatek zwiększający wrażliwość Pb(N3)2 na uderzenie |
Wyszukiwarka