ANNA BRACIKOWSKA
EWA CYRANKIEWICZ
OCHRONA ŚRODOWISKA
GRUPA A
ZESPÓŁ IV
ĆWICZENIE NR 13
TEMAT: POLAROGRAFIA - WPŁYW CZYNNIKÓW NA PRZEBIEG KRZYWEJ POLAROGRAFICZNEJ. WYZNACZANIE POTENCJAŁU PÓŁFALI JONÓW Zn2+.
Część teoretyczna
Szereg metod elektrochemicznych stosowanych w analizie chemicznej, opartych jest na zjawiskach zachodzących w układzie, w którym jedna z elektrod ulega polaryzacji. Takie zjawiska bada się najczęściej w oparciu o krzywe zależności natężenia prądu od przyłożonego napięcia. Ogólnie metody te określa się mianem woltoamperometrii. Polarografia jest jedną z takich metod.
Metodę polarograficzną podzielić można na:
-polarografię stałoprądową- klasyczną
-polarografię zmiennoprądową
-polarografię oscylacyjną- oscylopolarografię
Klasyczna metoda polarograficzna polega na badaniu zmian natężenia prądu, płynącego przez roztwór z oznaczaną substancją w czasie elektrolizy, od liniowo rosnącego potencjału, z zastosowaniem kroplowej elektrody rtęciowej(KER).
Do badania tych zmian opracowany został specjalny układ, w którym KER odgrywa szczególną rolę. Schemat układu przedstawia rysunek:
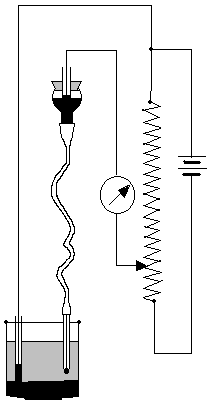
a)kroplowa elektroda rtęciowa
b)rtęć rozlana na dnie naczyńka
c)galwanometr
d)opornica
e)źródło prądu stałego
f)roztwór elektrolitu
Kroplowa elektroda rtęciowa jest w tym układzie katodą, natomiast anodę stanowi rtęć rozlana na dni naczyńka polarograficznego. Elektrodę zanurza się w roztworze elektrolitu nie ulegającego reakcjom elektrochemicznym, w przykładowym zakresie potencjału i zawierającego małe ilości kationów zdolnych do redukcji. Do elektrod przykłada się potencjał wzrastający powoli od 0V i obserwuje zmiany natężenia prądu. W układzie tym zachodzą następujące procesy: od katody, którą jest KER, zbliżają się kationy roztworu i tworzą wokół ujemnie naładowanej kropli rtęci warstwę dodatnio naładowanych jonów.
Tę podwójną warstwę elektryczną można rozpatrywać jako swego rodzaju kondensator ze zmienną powierzchnią, którego jedną okładką jest naładowana powierzchnia elektrody, a drugą warstwa jonów, znajdujących się w przestrzeni przyelektrodowej. W związku z małą powierzchnią KER, gęstość prądu na katodzie jest większa niż na anodzie.
Rys: Schemat podwójnej warstwy elektrycznej na KER
Krzywa zależności natężenia prądu „i” od liniowo rosnącego potencjału „E” rejestrowana jest w postaci fali polarograficznej:
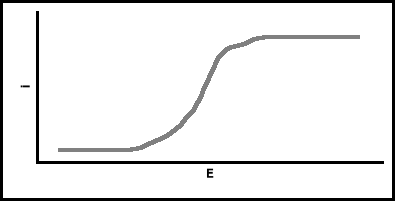
Krzywa polarograficzna pozwala zidentyfikować badaną substancję i określić jej stężenie. Pod względem jakościowym określa ją tzw. „potencjał półfali”- E½ , a wysokość fali (natężenie prądu granicznego)- h jest proporcjonalna do stężenia substancji analizowanej.
Na krzywej polarograficznej występują często zakłócenia spowodowane dostarczaniem depolaryzatora do powierzchni elektrody kroplowej, nie tylko na drodze dyfuzji. Obserwuje się wówczas gwałtowny wzrost natężenia prądu granicznego w postaci tzw. „maksimum”. Przyczyną tego zjawiska są wiry powstające w roztworze bez zewnętrznej przyczyny. Powodem może być nierównomierna polaryzacja kropli rtęci, nierówne napięcie powierzchniowe oraz ruchy powierzchni rtęci.
Maksima tłumi się za pomocą pewnych substancji celowo dodanych do elektrolitu podstawowego. Najbardziej uniwersalną substancją tłumiącą maksima jest żelatyna, która działa wystarczająco już w stężeniu 0,01%. Często do tłumienia maksimów stosuje się i inne środki powierzchniowo aktywne naturalne i syntetyczne.
Metodą polarograficzną można wykryć wiele depolaryzatorów znajdujących się w analizowanej mieszaninie, pod warunkiem, że ich potencjały półfali różnią się dostatecznie między sobą. Polarografię można stosować głównie do oznaczania małych zawartości składników w próbie, a przede wszystkim do oznaczania zanieczyszczeń w stosunkowo czystych materiałach.
Polarografię można stosować nie tylko do jonów prostych i kompleksowych, ale również cząsteczek organicznych i związków wielocząsteczkowych. Do innych zalet tej metody można zaliczyć szybkość wykonywania oznaczeń, minimalne zużycie oznaczanej substancji, a także przedstawienie trwałego dowodu w postaci krzywej polarograficznej.
Wnioski:
Wraz ze wzrostem ilości dodanego roztworu żelatyny(do roztworu podstawowego)malała fala polarograficzna, zanikały maksima. Działanie tłumiące miał także roztwórNa2SO3, tym większe, im wyższe było jego stężenie w roztworze. Kilka kropli 0,1n Na2SO3 nie dało dużego efektu tłumiącego, jednak 2ml roztworu nasyconego efektywnie zredukowało ilość zakłóceń na fali polarograficznej.
Dodawanie czynników tłumiących wpływa bardzo korzystnie na jakość fali polarograficznej. Bardzo dobry odczyt uzyskałyśmy także dodając do roztworu podstawowego obydwu czynników równocześnie.
Z polarogramu odczytałyśmy i wyznaczyłyśmy potencjał półfali jonów Zn² równy -0,85V
Dane literaturowe podają tę wielkość dla jonów cynku równą -1,02V
Różnica ta mogła wynikać z niedokładności odczytu, urządzenia lub prowadzenia ćwiczenia w innych warunkach niż standardowe, wykorzystane przez autorów opracowań literaturowych.
1
4
Wyszukiwarka