29.04.2005
1. Obliczanie ΔF lub ΔG reakcji:
Entalpia swobodna reakcji (ΔG) jest równa różnicy molowych entalpii swobodnych produktów i substratów, pomnożonych przez wartości bezwzględne ich współczynników stechiometrycznych.
![]()
(nie znane są wartości bezwzględne G)
Wielkości standardowe ΔGr0 są tak samo zdefiniowane dla warunków standardowych (temp = 298K =, p = 1013 hPa)
Można wykazać (podobnie jak wykazaliśmy dla entalpii według prawa Hessa), że
![]()
Entalpia swobodna tworzenia związku to zmiana entalpii swobodnych (ΔGitw)podczas reakcji syntezy 1 mola tego związku z pierwiastków w ich stanach trwałych w danych warunkach.
Wartości standardowych entalpii tworzenia pierwiastków ich stanach trwałych są = 0.
Ogólnie dla reakcji typu:
aA + bB cC + dD
![]()
2. Entalpia swobodna, a stała równowago chemicznej
G = H - TS
ΔG = ΔH - SΔT - TΔS w procesie izotermicznym ΔT = 0, zatem:
ΔG = ΔH - TΔS = Q + VΔp - TΔS = Q + VΔp - T(Q/T) = VΔp
W fazie gazowej obowiązuje równanie:
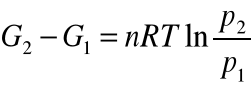
![]()
, stąd ![]()
, ![]()
po scałkowaniu:
p1 i p2 to ciśnienia parcjalne danej substancji w stanie 1 i 2
Przyjmijmy stan 1 za umowny stan standardowy dla czystej substancji w temperaturze 298 K i pod ciśnieniem 1013 hPa, wtedy mamy ogólnie, dla 1 mola tej substancji:
![]()
Dla reakcji w fazie gazowej typu:
aA + bB cC + dD
Zmiana entalpii swobodnej wyraża się wzorem:
![]()
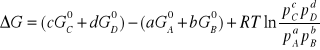
![]()
W równowadze :
![]()
![]()
lub
![]()
Zatem K jest stałą (zwaną stałą równowagi reakcji)
W reakcjach w roztworach idealnych iloraz ciśnień w powyższym równaniu jest zastąpiony wartościami stężeń reagentów.
3. Równowagi fazowe - rozważania nad wykresami dotyczącymi przemian fazowych.
Faza to układ lub część układu jednorodna makroskopowo (homogeniczna) pod względem własności fizycznych i chemicznych w całej przestrzeni oddzielona makroskopową granicą od innych części układu lub innych układów.
Substancje w różnych stanach skupienia stanowią różne fazy.
Heterogenne makroskopowo układy (np. zawiesiny) są układami wielofazowymi.
Zawiesiny są układami wielofazowymi. Rozdyspersowanie takich układów prowadzi do mikroheterogeniczności (jednofazowości). Roztwory koloidowe są zatem jednofazowe.
4. Fazy mogą być jedno lub wieloskładnikowe.
Składniki niezależne to substancje składowe fazy, których znajomość stężenia wystarcza do jednoznacznego opisu termodynamicznego fazy (5-cio składnikowa faza ma 4 niezależne składniki, jeśli pomiędzy 2 zachodzi reakcja faza ma tylko 3 niezależne składniki itd.)
W mieszaninie niereagujących ze sobą substancji liczba składników (n) jest równa liczbie składników niezależnych (α).
Jeśli składniki reagują ze sobą, to każda reakcja zmniejsza o 1 liczbę składników niezależnych w stosunku do ilości wszystkich składników.
α = n - r (r- liczba równań wiążących wartości stężeń poszczególnych składników, czyli liczba reakcji w układzie).
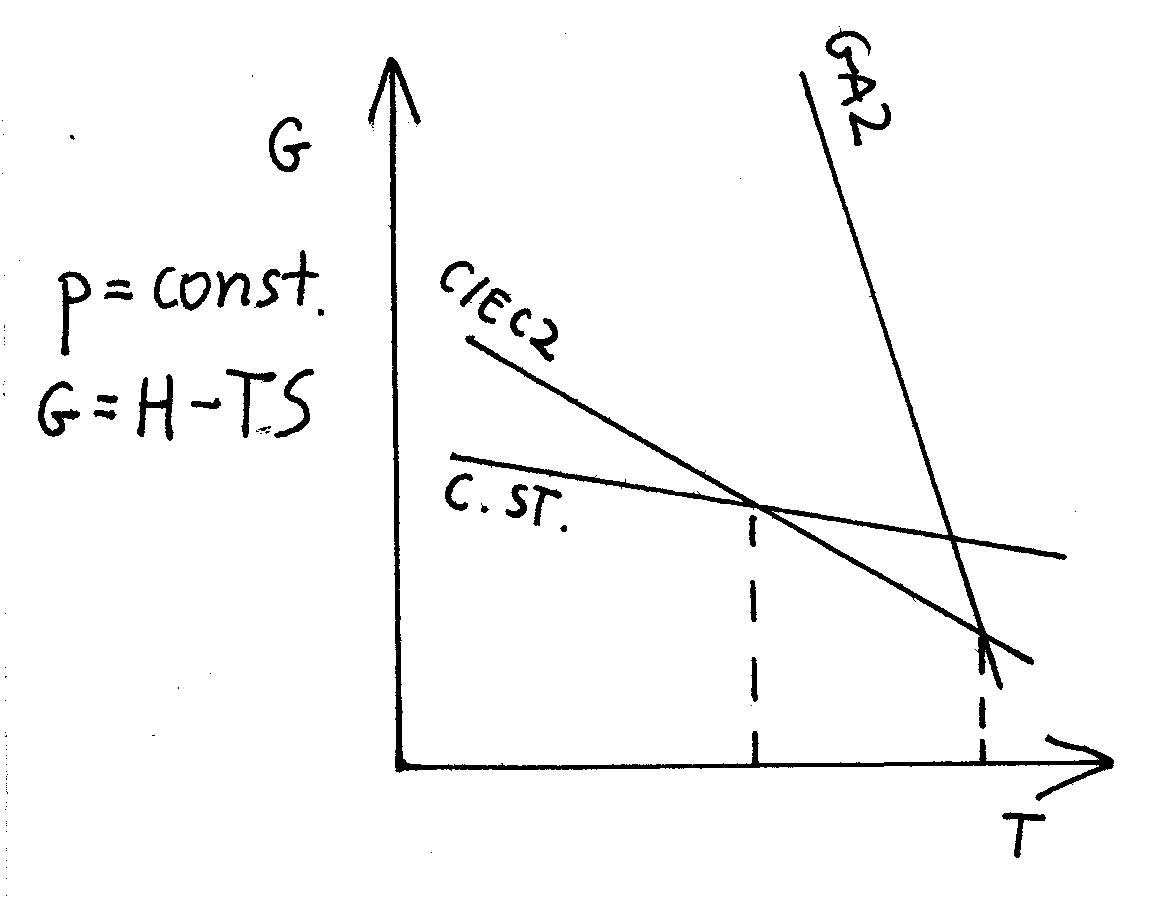
W miejscu przecięcia się dwóch wykresów znajdują się punkty temperaturowe równowagi dla dwóch faz.
Układy dążą samorzutnie do zmniejszenia wartości G.
Istnieją takie punkty, w których układy znajdują się w równowadze.
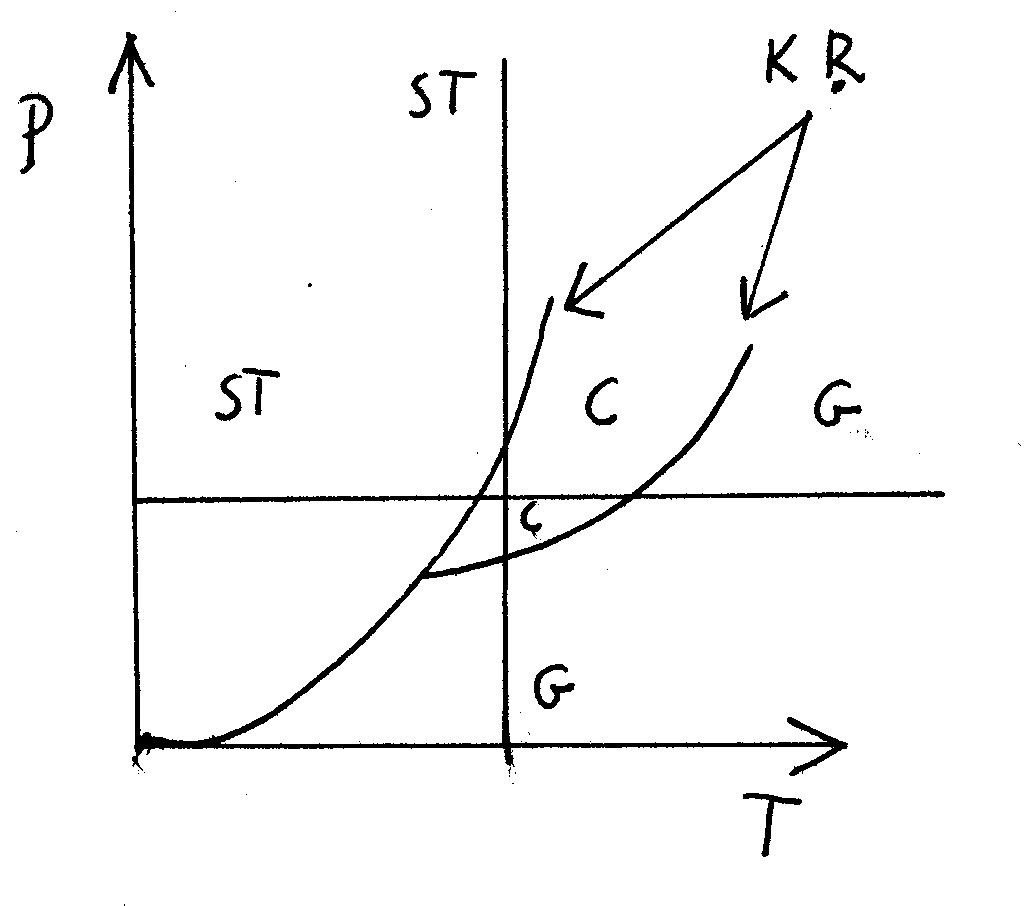
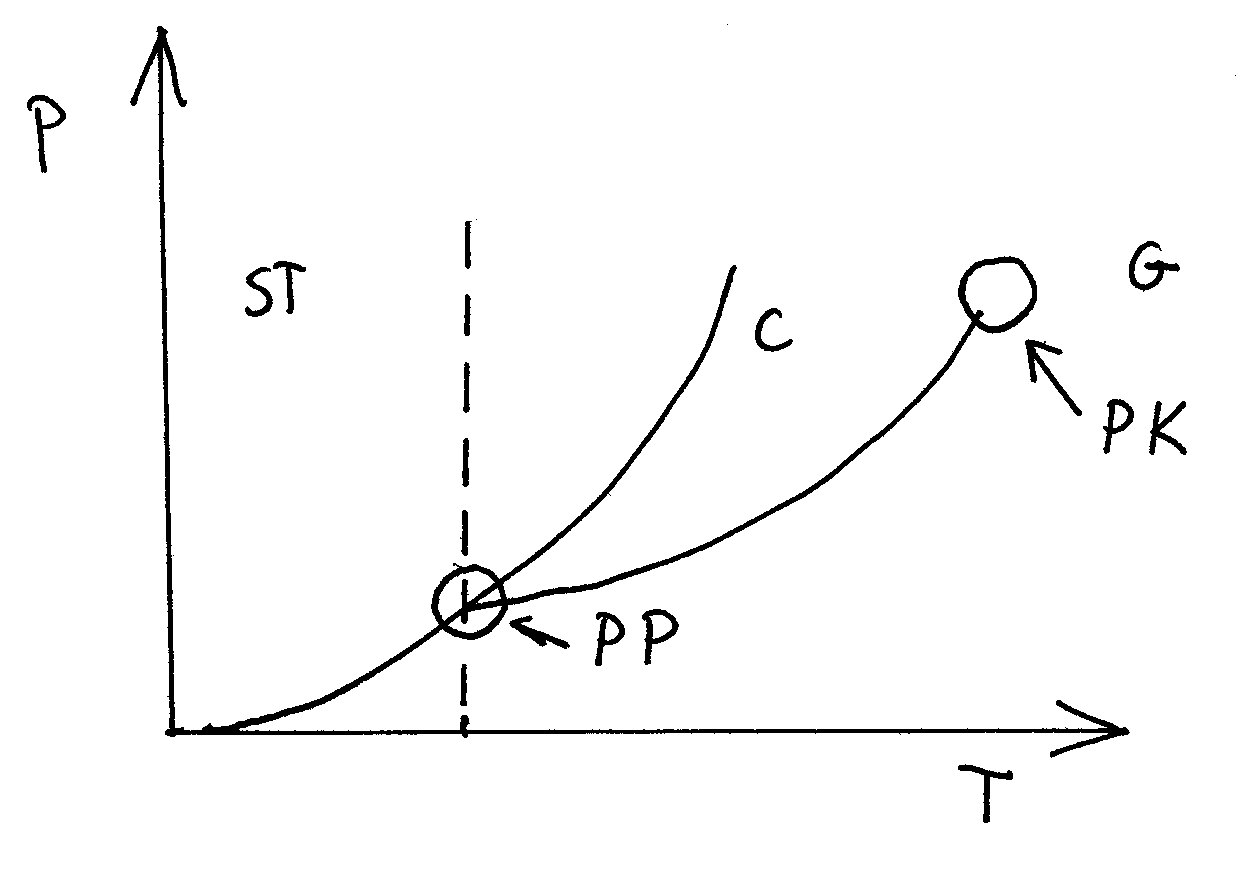
KR - krzywe równowagi
ST - ciało stałe
C - ciecz
G - gaz
Wykres fazowy to wykres wzajemnych zależności zmiennych parametrów układu, obrazujący zakresy tych wartości, w których fazy są stabilne lub w stanie równowagi z innymi fazami.
Wykresy fazowe konstruuje się na dwa sposoby: duża temperatura chłodzenie lub mała temperatura ogrzewanie.
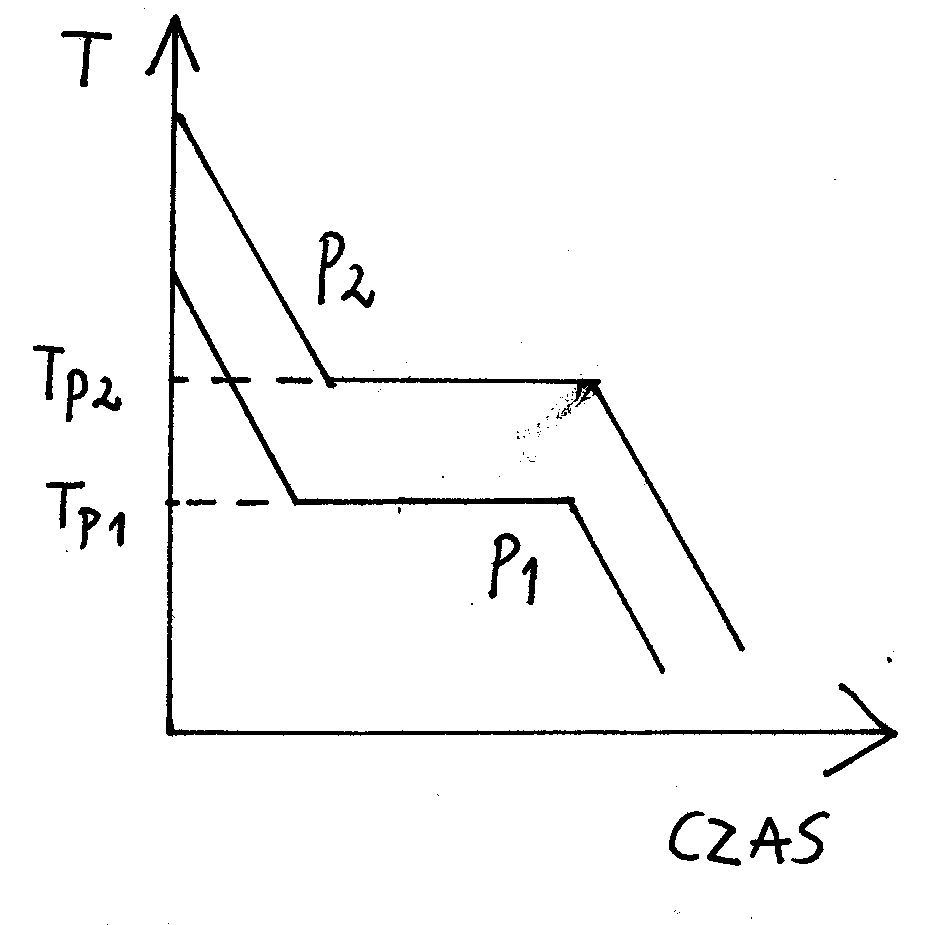
Na wykresach poniżej: Tp - temperatura przejścia fazowego, p - ciśnienie
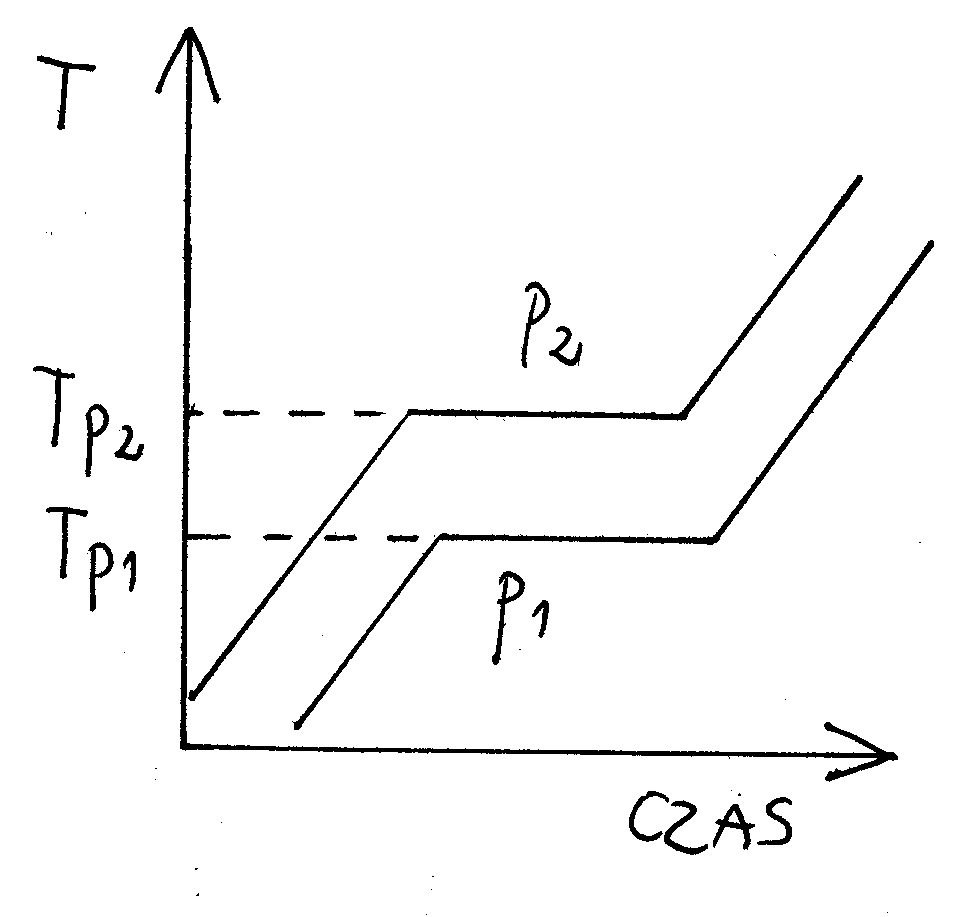
ST - ciało stałe
C - ciecz
G - gaz
PK - punkt krytyczny
PP - punkt potrójny
W punkcje potrójnym może wystąpić równowaga wszystkich trzech faz.
Poniżej punktu potrójnego może istnieć tylko ciało stałe.
Powyżej punktu krytycznego może istnieć tylko gaz.
Przemiany fazowe są zależne od wszystkich parametrów będących stopniami swobody.
Normalne temperatury przemiany (topnienia, krzepnięcia, wrzenia lub skraplania) to temperatury przemian pod ciśnieniem 1013 hPa.
Ciśnienie pary w równowadze z cieczą nazywa się ciśnieniem pary nasyconej (mierzymy manometrem rtęciowym).
Wzrost temperatury powoduje wzrost ciśnienia pary nasyconej aż do osiągnięcia stanu zrównania się z ciśnieniem zewnętrznym, wtedy następuje wrzenie (czyli parowanie całą objętością).
Gdy zwiększa się temperatura i ciśnienie (np. podgrzewanie w zamkniętym naczyniu), gęstość pary rośnie aż do zrównania się z gęstością cieczy (punkt krytyczny); powstaje faza nadkrytyczna (zanika granica między fazami).
W temperaturze wyższej od temperatury krytycznej nie może istnieć faza ciekła danej substancji.
Liczba stopni swobody (s) to ilość zmiennych parametrów intensywnych (T, p, stężenie składnika), których zmiana wartości nie zaburza równowagi układu.
4. Reguła faz Gibbsa
![]()
s - liczba stopni swobody
α - liczba składników niezależnych
β - liczba faz w równowadze
Liczba stopni swobody jest tym większa, im większa jest liczba składników i im mniejsza jest liczba faz w równowadze. Liczba stopni swobody nie może być ujemna.
Dla układu jednoskładnikowego reguła Gibbsa ma postać:
![]()
Punkt potrójny to zestaw wartości parametrów stanu, w którym mogą występować wszystkie trzy fazy w równowadze.
Zgodnie z regułą faz:
![]()
, β - liczba faz w równowadze;
Zatem dla układu jednoskładnikowego w punkcie potrójnym s = 0 brak stopni swobody (układ inwariantny).
W temperaturze niższej niż temperatura punktu potrójnego nie może istnieć faza ciekła dla większości substancji (oprócz substancji anomalnych, jak woda).
Dla substancji anomalnych przy ciśnieniu mniejszym od ciśnienia punktu potrójnego (ppotr) nie może istnieć w równowadze faza ciekła.
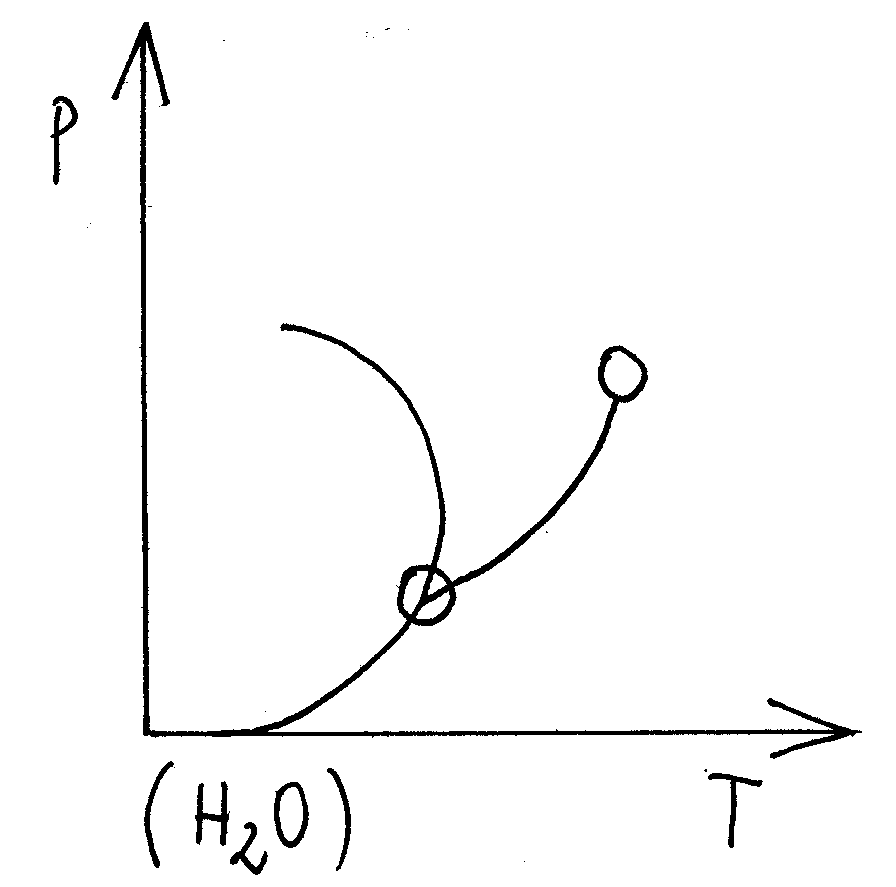
Dla wody parametry punktu potrójnego wynoszą:
Tpotr = 273,16;
ppotr = 611 hPa.
Układy wieloskładnikowe mają o wiele bardziej skomplikowane wykresy.
Do stopni swobody możemy zaliczyć wtedy także proporcje składników.
Przykładowo układ lipid - woda: s = 2 - β - 2; w równowadze współistnieć mogą nawet 4 fazy.
Wielkości cząstkowe w układach wieloskładnikowych:
a) wielkości parcjalne
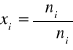
ułamek molowy (od 0 do 1); 1 w przypadku czystego składnika
![]()
molowa objętość cząstkowa
![]()
pi - ciśnienie cząstkowe danego składnika to ciśnienie pary, jakie wykazuje gazowy składnik w równowadze z roztworem
![]()
cząstkowa entalpia swobodna (gdy p = const)
![]()
cząstkowa entalpia swobodna (gdy V = const)
![]()
![]()
Prawo Rout'a (o mieszaninach)
Cząstkowe ciśnienie pary składnika roztworu jest proporcjonalne do ułamka molowego tego składnika w roztworze i do ciśnienia pary nad czystym składnikiem
![]()
,gdzie p* to ciśnienie nad czystą cieczą i
Prawo Henry'ego
Cząstkowe ciśnienie lotnego składnika w roztworze jest proporcjonalne do jego ułamka molowego w roztworze.
![]()
gdzie Ki to stała charakterystyczna dla i-tej substancji w danym roztworze i temperaturze
6
chemia fizyczna wykład z 29.04.2005
![]()
![]()
![]()
![]()
![]()
![]()
Wyszukiwarka