KONKURS CHEMICZNY
DLA UCZNIÓW GIMNAZJUM
ROK SZKOLNY 2007/2008
ETAP WOJEWÓDZKI
Informacje:
11. Brudnopis nie podlega ocenie. |
|
Uzyskane punkty |
|
|
|
|
|
|
|
1 |
|
|
|
2 |
|
|
|
3 |
|
|
|
4 |
|
|
|
5 |
|
|
|
6 |
|
|
|
7 |
|
|
|
8 |
|
|
|
9 |
|
|
|
10 |
|
|
|
11 |
|
|
|
12 |
|
|
|
Suma pkt |
|
Zadanie 1. (0 - 5pkt)
Sód jest pierwiastkiem należącym do I grupy układu okresowego pierwiastków. Oblicz stężenie procentowe roztworu otrzymanego po dodaniu 40,25 g sodu do 311,5 g wody oraz masę drugiego produktu.
Zadanie 2. (0 - 2pkt)
Dopuszczalna zawartość jonów azotanowych(V) (![]()
) w wodzie pitnej według norm Unii Europejskiej wynosi ![]()
. W pobranej próbce wody o objętości 30 cm3 wykryto 0,004 g jonów ![]()
. Na podstawie obliczeń uzasadnij, czy badana woda nadaje się do spożycia.
Informacje do zadań 3 i 4
Kwas azotowy(V) powstaje z amoniaku w cyklu przemian chemicznych. W wyniku katalitycznego utleniania amoniaku powstaje tlenek azotu(II), który samorzutnie utlenia się na powietrzu do tlenku azotu(IV). Tlenek azotu(IV) tworzy z wodą mieszaninę kwasów azotowego(III) i azotowego(V). Kwas azotowy(III) jest bardzo nietrwały i podczas zatężania rozkłada się z wydzieleniem tlenku azotu(II), który po utlenieniu ponownie bierze udział w procesie.
Zadanie 3. (0 - 2pkt)
Napisz schemat ciągu przemian na podstawie opisu otrzymywania kwasu azotowego(V).
……………………………………………………………………………………………………………………...
……………………………………………………………………………………………………………………...
……………………………………………………………………………………………………………………...
Zadanie 4. (0 - 4pkt)
Napisz równanie reakcji katalitycznego utleniania amoniaku np. tlenem cząsteczkowym, dobierając współczynniki metodą bilansu elektronowego. Wskaż utleniacz i reduktor.
...................................................................................................................................................................................
...................................................................................................................................................................................
...................................................................................................................................................................................
...................................................................................................................................................................................
...................................................................................................................................................................................
................................................................................................................................................................................... ...................................................................................................................................................................................
................................................................................................................................................................................... ...................................................................................................................................................................................
Zadanie 5. (0 - 3pkt)
Hydroksosole to związki, które tworzą wodorotlenki wielowodorotlenowe (wielohydroksylowe). Składają się one z kationów metalu, anionów wodorotlenkowych i anionów reszt kwasowych.
Patyna jest przykładem hydroksosoli. Powstaje na dachach wykonanych z blachy miedzianej pod wpływem wilgoci i dwutlenku węgla. W skład patyny wchodzą następujące pierwiastki: tlen, wodór, węgiel i miedź, która w związku jest dwuwartościowa.
Napisz wzór sumaryczny i podaj nazwę systematyczną tej soli. ....…………………………………………..
………………………………………………………………………………………………….……………….….
Napisz równanie reakcji patyny z kwasem solnym.
..……………………………………………………………………………………………….……………….….
..……………………………………………………………………………………………….……………….….
Zadanie 6. ( 0 - 3pkt)
Do 212 g wody wsypano 228 g azotanu(V) sodu (NaNO3). Ile gramów soli rozpuści się, a ile pozostanie w postaci osadu, jeżeli stężenie procentowe nasyconego roztworu azotanu(V) sodu wynosi 47%? Stężenie nasyconego roztworu oraz proces rozpuszczania mają miejsce w tej samej temperaturze.
………………………………………………………………………………………………….……………….….………………………………………………………………………………………………….……………….….………………………………………………………………………………………………….…………………..
…………………………………………………………………………….……………….….………………………………………………………………………………………………….……………….….………………………………………………………………………………………………….……………….….………………………………………………………………………………………………….……………….….………………………………………………………………………………………………….……………….….………………………………………………………………………………………………….……………….….……………………Odp. ..…………………………………………………………………….……………….….……………………
Informacje do zadań 7, 8, 9, 10 i 11.
Dane są trzy różne węglowodory.
Węglowodór pierwszy (1) jest związkiem łańcuchowym, dla którego stosunek molowy węgla do wodoru wynosi 5:12.
Węglowodór drugi (2) jest homologiem etynu (etinu, acetylenu). Gęstość tego gazu w warunkach normalnych wynosi
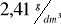
. W cząsteczce tego związku jeden (i tylko jeden) z atomów węgla połączony jest z dwoma atomami wodoru.Węglowodór trzeci (3) jest łańcuchowym węglowodorem nienasyconym o masie molowej równej
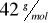
. Stosunek masowy węgla do wodoru w tym związku wynosi 6:1.
Zadanie 7. (0 - 5pkt)
Napisz wzory sumaryczne wszystkich trzech węglowodorów przedstawiając swój tok rozumowania.
...................................................................................................................................................................................
...................................................................................................................................................................................
...................................................................................................................................................................................
...................................................................................................................................................................................
...................................................................................................................................................................................
...................................................................................................................................................................................
...................................................................................................................................................................................
................................................................................................................................................................................... ...................................................................................................................................................................................
...................................................................................................................................................................................
................................................................................................................................................................................... ................................................................................................................................................................................... ................................................................................................................................................................................... .............................................................................................................................................................................. …
Zadanie 8. (0 - 3pkt)
Narysuj wzory półstrukturalne (grupowe) węglowodorów podanych w informacji oraz podaj ich nazwy systematyczne.
...................................................................................................................................................................................
...................................................................................................................................................................................
................................................................................................................................................................................... ................................................................................................................................................................................... ................................................................................................................................................................................... ...................................................................................................................................................................................
Zadanie 9. (0 - 3pkt)
Używając wzorów półstrukturalnych (grupowych), zapisz równanie reakcji węglowodoru nr 2 z chlorowodorem, jeśli wiadomo, że w reakcji tej stosunek molowy węglowodoru do chlorowodoru wynosi 1:1. Napisz systematyczną nazwę produktu tej reakcji oraz podaj jej typ (substytucji - podstawiania, addycji - przyłączania, eliminacji).
...................................................................................................................................................................................
...................................................................................................................................................................................
................................................................................................................................................................................... ................................................................................................................................................................................... ................................................................................................................................................................................... ................................................................................................................................................................................... ................................................................................................................................................................................... ................................................................................................................................................................................... ...................................................................................................................................................................................
Zadanie 10. (0 - 2pkt)
W jakim stosunku masowym przereagował węglowodór nr 3 z tlenem, jeżeli jednym z produktów tej reakcji jest bezbarwny gaz o gęstości mniejszej od gęstości powietrza? Zapisz równanie tej reakcji. (gęstość powietrza wynosi ![]()
)
Równanie reakcji .....................................................................................................................................................
stosunek masowy……............................................................................................................................................ …..............................................................................................................................................................................
...................................................................................................................................................................................
Zadanie 11. (0 - 2pkt)
Węglowodory nr 1 i nr 2 są w temperaturze pokojowej bezbarwnymi gazami. Podaj nazwę lub wzór odczynnika, jakiego należy użyć, aby rozróżnić te związki. Napisz obserwacje, jakie towarzyszyłyby przebiegowi tego doświadczenia.
Odczynnik ................................................................................................................................................................
Obserwacje ...............................................................................................................................................................
................................................................................................................................................................................... ...................................................................................................................................................................................
...................................................................................................................................................................................
...................................................................................................................................................................................
...................................................................................................................................................................................
Zadanie 12. (0 - 8pkt)
Napisz równania reakcji przedstawione na schemacie z określeniem warunków przebiegu procesów. W równaniach 1, 2, 3 zastosuj wzory sumaryczne, a w równaniach 4, 5, 6 wzory półstrukturalne związków.
![]()
...................................................................................................................................................................................
...................................................................................................................................................................................
................................................................................................................................................................................... ...................................................................................................................................................................................
...................................................................................................................................................................................
...................................................................................................................................................................................
|
Wpisuje uczeń po otrzymaniu zadań |
|
||
|
Wch |
|
|
|
Wpisać po rozkodowaniu pracy |
|
|||
|
|
Czas pracy: 90 minut |
||
|
|
|
||
Odp. …………………………………………………………………………………………………………
Odp. ………………………………………………………………………………………………………..
Wyszukiwarka