Obliczanie pH roztworów mocnych oraz słabych kwasów i zasad - przykładowe zadania
Obliczyć stężenie jonów wodorowych i wartość pH w 0,001 mol/L roztworze HNO3 przyjmując, że współczynnik aktywności jonów w tym roztworze wynosi 0,91.
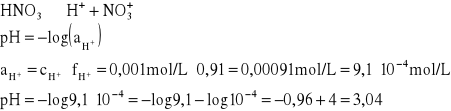
Ile mg NaOH znajduje się w 200 mL roztworu wodorotlenku sodu o pH = 9?
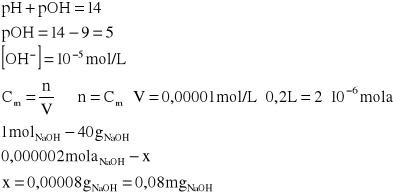
Obliczyć stężenie jonów wodorowych i wodorotlenowych w roztworze o pH = 3,7.
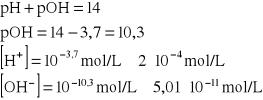
Do 200 mL roztworu HCl o stężeniu 0,1 mol/L dodano 100 mL roztworu NaOH o stężeniu 0,15 mol/L. Obliczyć pH otrzymanego roztworu.
Ile razy zwiększy się stopień dysocjacji, jeżeli roztwór słabego kwasu HA o stężeniu 0,05 mol/L rozcieńczymy 10 - krotnie? K = 1,25∙10-7.

Jakie jest stężenie jonów H+ w 0,5 mol/L roztworze HNO2? K = 4∙10-4.
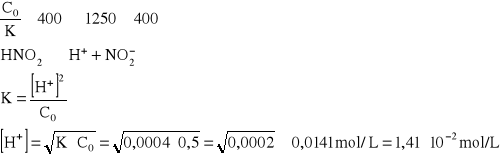
Ile wynosi stopień dysocjacji kwasu chlorowego(III) o stężeniu 0,5 mol/L. K = 5∙10-3.
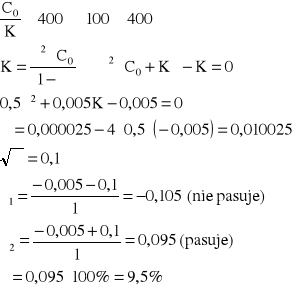
![]()
Stopień dysocjacji 0,1 mol/L słabego kwasu wynosi 4,5%. Obliczyć stężenie jonów H+ w tym roztworze.
I sposób

II sposób

Obliczyć pH 0,05 mol/L roztworu kwasu octowego, którego stała dysocjacji równa się K = 1,8∙10-5.
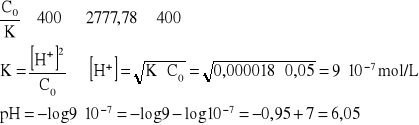
![]()
pH 0,02 mol/L roztworu słabego kwasu HA wynosi 3. Obliczyć stałą dysocjacji K tego kwasu.

Obliczanie pH mieszanin buforowych - przykładowe zadania
Do 100 mL roztworu kwasu octowego o stężeniu 0,5 mol/L dodano 4,63 g octanu sodu, a następnie roztwór rozcieńczono wodą destylowaną do objętości 250 mL. Obliczyć pH otrzymanego roztworu. Kk = 1,79·10-5,
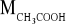
- 82 g/mol.

Do 200 mL roztworu kwasu octowego o stężeniu 0,1 mol/L dodano 200 mL roztworu NaOH o pH = 12. Obliczyć pH otrzymanego roztworu. Kk = 1,79·10-5.
![]()
na początku
![]()
na początku
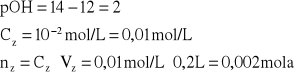
w buforze
![]()
w buforze
![]()

800 mL roztworu zawiera 25 g KH2PO4 i 35 g K2HPO4. Jak zmieni się pH tego roztworu po dodaniu:
a) 200 mL wody destylowanej;
b) 200 mL roztworu HCl o stężeniu 0,2 mol/L;
c) 200 mL roztworu NaOH o stężeniu 0,2 mol/L.
Kk,2 = 1,6·10-7.

ad. a)

ad. b)
![]()

ad. c)

Do 100 mL roztworu amoniaku o stężeniu 0,5 mol/L dodano 400 mL roztworu HCl o pH = 1. Stała dysocjacji NH4OH to Kz = 1,79·10-5. Obliczyć pH otrzymanego roztworu. O jaką wartość zmieni się pH otrzymanego buforu, jeżeli dodano do niego:
a) 10 mL roztworu NaOH o stężeniu 0,5 mol/L;
b) 10 mL roztworu HCl o stężeniu 0,5 mol/L.
![]()
na początku
![]()
na początku
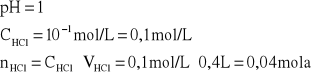
w buforze
![]()
w buforze
![]()

ad. a)
![]()

ad. b)
![]()

Ile gramów octanu sodu należy dodać do 1 litra roztworu kwasu octowego o stężeniu 0,1 mol/L, aby otrzymać bufor octanowy o pH = 5. Stała dysocjacji kwasu octowego Kk = 1,8·10-5.

Jaką objętość roztworu kwasu octowego o stężeniu 0,4 mol/L oraz jaką objętość roztworu octanu sodu o stężeniu 0,18 mol/L należy zmieszać, aby otrzymać 100 mL buforu octanowego o pH = 5. Stała dysocjacji kwasu octowego Kk = 1,8·10-5.
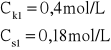
![]()

Ile mL 1 mol/L roztworu HCl należy dodać do 1 L roztworu Na2HPO4 o stężeniu 0,1 mol/L, aby otrzymać roztwór buforu fosforanowego o pH = 7,4? Kk = 6,3∙10-8.
![]()
na początku
![]()
na początku
![]()
w buforze
![]()
w buforze
![]()
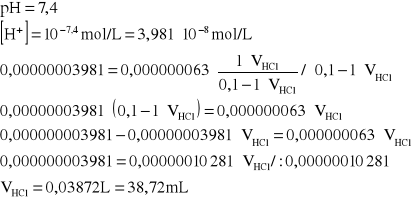
Wyszukiwarka