Wprowadzenie
Ilość ciepła wydzielonego (względnie pochłoniętego) w kalorymetrze przez 1 mol reagenta obliczamy ze wzoru:
![]()
(*)
gdzie:
K - pojemność cieplna układu kalorymetrycznego
∆t - zmiana temperatury układu kalorymetrycznego
Σv - poprawka uwzględniająca wymianę ciepła z otoczeniem podczas pomiaru
m - odważka substratu wziętego w nadmiarze stechiometrycznym
M - masa molowa tego substratu
Jeżeli w kalorymetrze zachodzi jednocześnie kilka procesów o różnych efektach to oznaczona wielkość jest ich sumą:
Q = q1 + q2 + q3 + …itd.
Ciepło rozpuszczania - ciepło jakie wydzieliło się podczas rozpuszczania 1 mola substratu w takiej ilości rozpuszczalnika, że powstanie roztwór nasycony.
Ciepło zobojętniania - ciepło powstałe w reakcji zobojętniania kwasu z zasadą, w wyniku której powstaje woda i sól. Efekt cieplny łączenia się jonów H+ i OH-.
W celu wykonania ćwiczenia (pomiar ciepła zobojętniania) posłuży nam kalorymetr diatermiczny. Jest on używany do oznaczania ciepła reakcji chemicznych w fazie ciekłej. Osłonę zewnętrzną kalorymetru stanowi naczynie Dawera (termos), które ma na celu zmniejszyć wymianę ciepła między kalorymetrem a otoczeniem.
Sposób wykonania doświadczenia: do naczynia Dowera wlewamy 600ml zwykłej wody. W uchwycie umieszczamy szklaną ampułkę ze znaną ilością kwasu siarkowego. Przykręcamy mieszadełko, które spowoduje, że temperatura cieczy wszędzie będzie taka sama. Umieszczamy sondę pomiarową w przeznaczonym na nią miejscu. Po zmontowaniu całego urządzenia wykonujemy 10 pomiarów co 30 sekund. Następnie tłuczemy ampułkę tak, aby kwas siarkowy zmieszał się z wodą. Kolejne 10 pomiarów odczytujemy co 10 sekund, a następne 10 co 30 sekund. Drugą część doświadczenia wykonujemy analogicznie tylko zamiast wody w naczyniu Dowera umieszczamy wodny roztwór wodorotlenku sodu.
H2SO4 + 2NaOH → 2H2O + Na 2SO4
Pomiary i obliczenia
Masa kwasu siarkowego w 1. ampułce - 3,005 g
Masa kwasu siarkowego w 2. ampułce - 2,08 g
Objętość wodorotlenku sodu - 3,62 cm3
(1) Ampułka zanurzona w wodzie |
(2) Ampułka zanurzona w roztworze NaOH |
|||||
L.p.. |
Czas (s) |
Rezystancja kΩ |
Temperatura (˚C) |
Czas (s) |
Rezystancja kΩ |
Temperatura (˚C) |
1 |
30 |
22,86 |
15,023 |
30 |
24,40 |
13,617 |
2 |
60 |
22,86 |
15,023 |
60 |
24,40 |
13,617 |
3 |
90 |
22,865 |
15,018 |
90 |
24,40 |
13,617 |
4 |
120 |
22,865 |
15,018 |
120 |
24,405 |
13,613 |
5 |
150 |
22,87 |
15,014 |
150 |
24,405 |
13,613 |
6 |
180 |
22,87 |
15,014 |
180 |
24,405 |
13,613 |
7 |
210 |
22,875 |
15,009 |
210 |
24,405 |
13,613 |
8 |
240 |
22,875 |
15,009 |
240 |
24,405 |
13,613 |
9 |
270 |
22,88 |
15,004 |
270 |
24,405 |
13,613 |
10 |
300 |
22,88 |
15,004 |
300 |
24,405 |
13,613 |
Pomiary po stłuczeniu ampułki z kwasem siarkowym (H2SO4) |
||||||
11 |
310 |
22,20 |
15,659 |
310 |
23,47 |
14,454 |
12 |
320 |
22,09 |
15,768 |
320 |
23,36 |
14,555 |
13 |
330 |
22,08 |
15,777 |
330 |
23,34 |
14,573 |
14 |
340 |
22,07 |
15,787 |
340 |
23,33 |
14,583 |
15 |
350 |
22,07 |
15,787 |
350 |
23,33 |
14,583 |
16 |
360 |
22,07 |
15,787 |
360 |
23,33 |
14,583 |
17 |
370 |
22,07 |
15,787 |
370 |
23,33 |
14,583 |
18 |
380 |
22,07 |
15,787 |
380 |
23,33 |
14,583 |
19 |
390 |
22,07 |
15,787 |
390 |
23,33 |
14,583 |
20 |
400 |
22,08 |
15,777 |
400 |
23,33 |
14,583 |
21 |
430 |
22,08 |
15,777 |
430 |
23,33 |
14,583 |
22 |
460 |
22,08 |
15,777 |
460 |
23,33 |
14,583 |
23 |
490 |
22,085 |
15,773 |
490 |
23,335 |
14,578 |
24 |
520 |
22,09 |
15,768 |
520 |
23,335 |
14,578 |
25 |
550 |
22,095 |
15,763 |
550 |
23,335 |
14,578 |
26 |
580 |
22,10 |
15,758 |
580 |
23,34 |
14,573 |
27 |
610 |
22,10 |
15,758 |
610 |
23,34 |
14,573 |
28 |
640 |
22,11 |
15,748 |
640 |
23,34 |
14,573 |
29 |
670 |
22,11 |
15,748 |
670 |
23,345 |
14,569 |
30 |
700 |
22,11 |
15,748 |
700 |
23,35 |
14,564 |
Początkowe wskazania:
ampułka zanurzona w wodzie - 22,83 kΩ
ampułka zanurzona w roztworze - 24,36 kΩ
Temperatura została wyliczona ze wzoru:
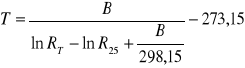
gdzie pod wartości B (stała materiałowa o wymiarze deg - stopień) i R25 (znormalizowana rezystancja) podstawiono stałe dla białej sondy:
B = 3832 (deg)
R25 = 14,65 (kΩ)
Minimalna (praktycznie znikoma) zmiana temperatury w okresie głównym jest potwierdzeniem prawa Hessa:
„ciepło reakcji chemicznej (w warunkach izobarycznych lub izochorycznych) nie zależy od drogi, którą biegnie reakcja, a jedynie od stanu początkowego i końcowego reakcji”.
Wyliczenia do pierwszej części ćwiczenia (ampułka z kwasem w wodzie):
Molowe ciepła rozpuszczania kwasu siarkowego w zależności od rozcieńczenia
|
∞ |
20000 |
8000 |
4000 |
1000 |
600 |
200 |
100 |
50 |
20 |
10 |
Q (kJ/mol) |
92,39 |
87,95 |
85,52 |
83,00 |
78,19 |
76,80 |
74,37 |
73,49 |
72,78 |
71,40 |
66,20 |
Wyliczam liczbę moli kwasu siarkowego w pierwszej ampułce:
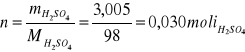
Na 1 mol kwasu siarkowego przypada 1111 moli wody. Znając molowe ciepła rozpuszczania kwasu w zależności od rozcieńczenia ( tabelka powyżej) można określić ciepło jakie powstało w reakcji:
Qrozp.≈ 78,19 ![]()
Wartość (Δt + ∑v) można wyznaczyć graficznie ( co zostało wykonane na wykresie poniżej) ale tą sumę można wyliczyć z zależności:
(Δt + ∑v)= TII - TI
gdzie: TI - końcowa temperatura okresu początkowego
TII - początkowa temperatura okresu końcowego
Powyższe wartości zostały wyliczone i umieszczone w tabeli na stronie 2.
(Δt + ∑v)= TII - TI = 15,777 - 15,004 = 0,773
Na podstawie wzoru (*) zawartego na stronie 1. wyliczam pojemność cieplną układu:
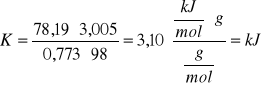
Pojemność cieplna jest wartością stałą dla konkretnego układu, dlatego też powyższa wartość zostanie wykorzystana w dalszych obliczeniach.
Wyliczenia do drugiej części ćwiczenia (ampułka z kwasem w roztworze):
Podobnie jak w części pierwszej należy wyliczyć wartość (Δt + ∑v).
(Δt + ∑v)= TIV - TIII
gdzie: TIII - końcowa temperatura okresu początkowego
TIV - początkowa temperatura okresu końcowego
Powyższe wartości zostały wyliczone i umieszczone w tabeli na stronie 2.
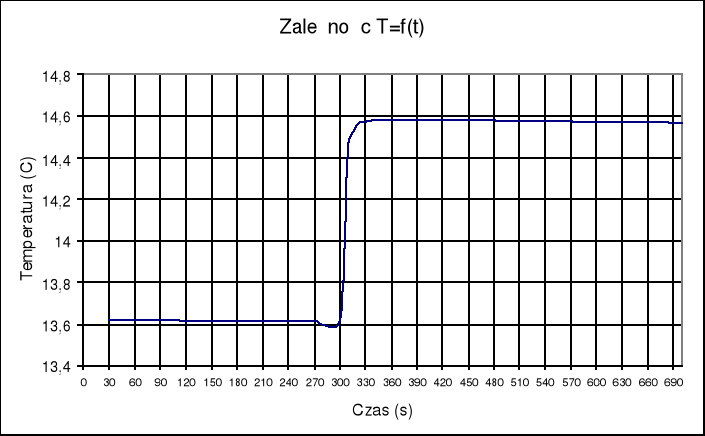
(Δt + ∑v)= TIV - TIII = 14,583 - 13,613 = 0,97
Znając pojemność cieplną układu, masę kwasu siarkowego, jego masę molową i wartość (Δt + ∑v) można wyliczyć ciepło zobojętnienia:
![]()
![]()
W wykonanym ćwiczeniu miały miejsce dwa procesy o różnych efektach cieplnych, dlatego też ilość ciepła jakie wydzieliło się w kalorymetrze jest sumą ciepła rozpuszczania i ciepła zobojętnienia :
Q = Qrozp. + Qzob.
Q = 78,19 + 141,67
Q = 219,86 ![]()
Wnioski
Proces zobojętniania mocnej zasady za pomocą mocnego kwasu jest w istocie relacją pomiędzy jonami H+ a OH- z utworzeniem słabo zdysocjowanej cząsteczki wody:
H+ + OH- → H2O
Efekt cieplny tej reakcji wynosi około 13,7 kcal (57359). Wielkość ta praktycznie jest niezależna od rodzaju mocnej zasady i mocnego kwasu.
W ćwiczeniu został użyty słaby kwas, który w stanie równowagi pozostaje mieszaniną kwasu, jonów wodorowych oraz sprzężonej z tym kwasem zasady:
H2SO4 → 2H+ +SO42-
Jeżeli w procesie zobojętniania zostanie użyta słaba zasada lub słaby kwas, to obserwowany efekt cieplny różni się znacznie od powyższej wartości, jaka jest podana dla mocnego kwasu i mocnej zasady. Wynika to stąd, że podczas zobojętniania słabego kwasu musi towarzyszyć proces dysocjacji tego kwasu.
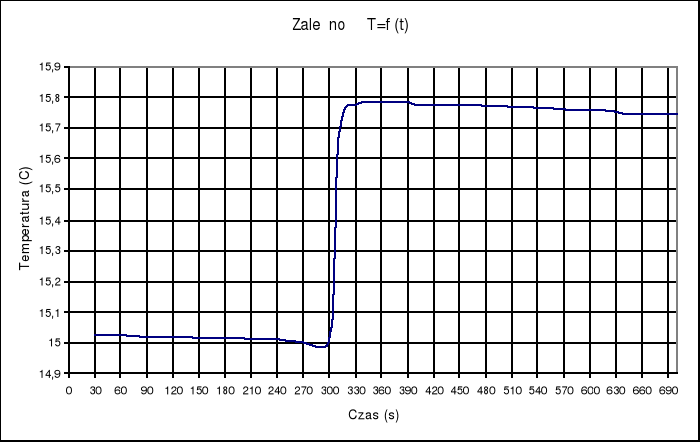
Ampułka z kwasem w roztworze wodorotlenku sodu:
Ewa Nogawska Pomiary kalorymetryczne
Wyszukiwarka