Oznaczenia w odpadach galwanicznych zawierających chrom po oddzieleniu na prasie filtracyjnej
1 a. Temat ćwiczenia: Przygotowanie wyciągu wodnego z odpadów stałych
Celem ćwiczenia jest przeprowadzenie ługowania rozpuszczalnych substancji chemicznych z odpadów stałych. Zawartość substancji wyraża się w g/dm3, mg/dm3, lub mval/dm3.
Metoda przygotowania wyciągu wodnego z odpadów stałych polega na wymyciu wodą destylowaną zanieczyszczeń, znajdujących się w badanych odpadach, i oddzieleniu składników nierozpuszczonych.
Odczynniki:
- woda destylowana.
Aparatura i sprzęt laboratoryjny:
- waga analityczna,
- kolba stożkowa z korkiem o pojemności 250 cm3, lejek, sączek bibułowy,
- butelka z korkiem.
Wykonanie ćwiczenia
Odważyć na wadze analitycznej około 50 g rozdrobnionych odpadów i przenieść do kolby, zawierającej 0,5 dm3 wody destylowanej.
Wytrząsać zawartość przez 25 minut.
Otrzymany roztwór pozostawić do opadnięcia ciężkich cząstek.
Ciecz zdekantować (do butelki), przesączając ją przez sączek bibułowy.
1b. Temat ćwiczenia: Oznaczenie pH wyciągu z odpadów
Cel ćwiczenia: Określenie pH wyciągu wodnego z odpadów.
Odczyn wód naturalnych zawiera się w zakresie pH 6,8 - 7,3. Większe odchylenia od wartości pH = 7 świadczą o zanieczyszczeniu wody ściekami lub produktami rozkładu związków organicznych.
Metoda polega na potencjometrycznym pomiarze siły elektromotorycznej w układzie: elektroda kombinowana - wyciąg wodny z odpadów. Zmierzona SEM badanego układu pozwala wyznaczyć pH.
Odczynniki:
- woda destylowana,
- roztwory buforowe do kalibracji pH-metru.
Aparatura i sprzęt laboratoryjny:
- pH-metr laboratoryjny o zakresie pomiarowym pH 0 - 14,
- zlewka o pojemności 50 cm3,
- tryskawka.
Wykonanie oznaczenia:
Elektrodę kombinowaną zanurzyć w wyciągu z odpadów, podczas pomiaru elektroda nie powinna dotykać ścianek ani dna zlewki. Pomiar należy powtórzyć trzykrotnie.
Wnioski:
Uzyskany wynik należy porównać z danymi literaturowymi dotyczącymi pH odcieków ze składowisk, ścieków komunalnych i wyciągu z kompostów.
1c. Temat ćwiczenia: Oznaczenie kwasowości ogólnej (Kp) i mineralnej (Km) w wyciągu wodnym z odpadów
Kwasowość wody to zdolność wody do zobojętniania dodawanych do niej mocnych zasad nieorganicznych lub węglanów potasowców. Kwasowość jest spowodowana obecnością rozpuszczonego ditlenku węgla, słabych kwasów organicznych (humusowych), kwasów nieorganicznych oraz produktów hydrolizy niektórych soli. Czynniki powodujące kwasowość mogą pochodzić z atmosfery, koagulantów dodawanych do wody podczas jej uzdatniania i zanieczyszczeń ściekowych.
Kwasowość mineralna (Km) wyraża ilościową zawartość mocnych kwasów, występuje gdy pH < 4,6, a oznacza się ją przez miareczkowanie mocną zasadą (NaOH) wobec oranżu metylowego.
Kwasowość ogólna wyraża ilościową zawartość mocnych kwasów i soli mocnych kwasów i słabych zasad. Występuje w zakresie pH od 4,6 - 8,3, a oznacza się ją wodorotlenkiem sodu wobec fenoloftaleiny lub potencjometrycznie.
Celem ćwiczenia jest określenie kwasowości wyciągu wodnego z odpadów metodą miareczkową.
Metoda oznaczenia polega na miareczkowaniu badanej próbki mianowanym roztworem wodorotlenku sodu wobec oranżu metylowego do zmiany barwy z czerwonej do żółtej (Km) oraz wobec fenoloftaleiny do wyraźnie różowej barwy (Kp).
Odczynniki:
- 0,1% roztwór fenoloftaleiny,
- 0,1% roztwór oranżu metylowego,
- 0,05 M roztwór wodorotlenku sodu.
Sprzęt laboratoryjny:
- cylinder miarowy o pojemności 25 cm³,
- kolby stożkowe o pojemności 250 cm³,
- biureta o pojemności 25 cm³,
- tryskawka,
- pipety.
Wykonanie oznaczenia kwasowości ogólnej
Do kolbki stożkowej odmierzyć pipetą 50 cm³ badanego roztworu i dodać 4 krople fenoloftaleiny. Jeżeli roztwór będzie lekko różowy, świadczy to o braku kwasowości ogólnej. W przypadku roztworu bezbarwnego, próbkę miareczkować 0,05 M wodorotlenkiem sodu do różowego zabarwienia utrzymującego się 3 minuty.
Kwasowość ogólną obliczyć ze wzoru:
![]()
gdzie:
a - ilość wodorotlenku sodu zużytego do miareczkowania próbki, cm³,
cM- stężenie molowe wodorotlenku sodu, mol/dm3,
v - objętość próbki użytej do oznaczenia, cm³.
Wykonanie oznaczenia kwasowości mineralnej
Do kolbki stożkowej odmierzyć pipetą 50 cm³ badanego roztworu i dodać 4 krople oranżu metylowego. Jeżeli barwa roztworu będzie czerwona lub pomarańczowa, to próbkę należy miareczkować wodorotlenkiem sodu do zmiany barwy na żółtą.
Kwasowość mineralną obliczyć ze wzoru:
![]()
gdzie:
a - ilość wodorotlenku sodu zużytego do miareczkowania próbki, cm³,
cM - stężenie molowe wodorotlenku sodu, mol/dm3,
v - objętość próbki użytej do oznaczenia, cm3.
Za wyniki końcowe oznaczeń należy przyjąć średnią arytmetyczną wyników trzech równolegle wykonanych oznaczeń, różniących się nie więcej niż 0,1 mval/dm3.
Wnioski
Otrzymane wyniki porównać z normami obowiązującymi w Polsce dla wody i ścieków.
1d. Temat ćwiczenia: Oznaczenie zasadowości mineralnej (Zm) i zasadowości ogólnej (Zp) w wyciągu wodnym z odpadów
Zasadowość jest zdolnością do zobojętniania kwasów mineralnych w określonych warunkach. W zależności od zawartego związku, wyróżnia się następujące rodzaje zasadowości badanej wody: zasadowość ogólna (Zm), zasadowość wobec fenoloftaleiny, tzn. mineralna (Zp), zasadowość węglanowa (![]()
), zasadowość wodorowęglanowa (![]()
) i zasadowość wodorotlenowa (![]()
).
Zasadowość ogólna oznacza sumę wszystkich związków chemicznych w wyciągu wodnym z odpadów, które reagują zasadowo wobec oranżu metylowego (pH > 4,5). Zasadowość wobec fenoloftaleiny oznacza sumę wszystkich związków reagujących zasadowo powyżej pH 8,3.
Metoda oznaczenia polega na miareczkowaniu badanej próbki mianowanym roztworem kwasu solnego wobec fenoloftaleiny do zaniku różowego zabarwienia (Zm) oraz wobec oranżu metylowego do pierwszej zmiany barwy (Zp).
Celem ćwiczenia jest określenie stopnia zasadowości wyciągu wodnego z odpadów metodą miareczkową.
Odczynniki:
- 0,1% roztwór fenoloftaleiny,
- 0,1% roztwór oranżu metylowego,
- 0,05 M roztwór kwasu solnego.
Sprzęt laboratoryjny:
- cylinder miarowy o pojemności 25 cm³,
- kolby stożkowe o pojemności 250 cm³,
- biureta o pojemności 25 cm³,
- tryskawka,
- pipety.
Wykonanie oznaczenia zasadowości mineralnej
Do kolbki stożkowej odmierzyć pipetą 50 cm³ badanego roztworu i dodać 4 krople fenoloftaleiny. Jeżeli roztwór będzie bezbarwny, świadczy to o braku zasadowości ogólnej. Po uzyskaniu różowego zabarwienia roztworu, próbkę miareczkować 0,05 M roztworem kwasu solnego aż do odbarwienia roztworu.
Zasadowość mineralną obliczyć ze wzoru:
![]()
, mval/dm3
gdzie:
a - ilość kwasu solnego zużytego do miareczkowania próbki, cm3,
cM - stężenie molowe kwasu solnego, mol/dm3,
v - objętość próbki użytej do oznaczenia, cm3.
Wykonanie oznaczenia zasadowości ogólnej
Do badanego przesączu po oznaczeniu Zp dodać 3 krople oranżu metylowego. Jeżeli roztwór ma barwę pomarańczową, świadczy to o braku zasadowości mineralnej. Po uzyskaniu żółtego zabarwienia miareczkować badany roztwór kwasem solnym do zmiany barwy na pomarańczową.
Zasadowość ogólną obliczyć ze wzoru:
![]()
gdzie:
a - ilość kwasu solnego zużytego do miareczkowania próbki, cm3,
cM - stężenie molowe kwasu solnego, mol/dm3,
v - objętość próbki użytej do oznaczenia, cm3.
Wnioski
Otrzymane wyniki porównać z normami obowiązującymi w Polsce dla wody i ścieków.
1 e. OZNACZENIE TWARDOŚCI OGÓLNEJ W WYCIĄGU WODNYM Z ODPADÓW
Twardość ogólna (Tog) określa całkowitą zawartość kationów dwuwartościowych w wodzie. W wodach naturalnych istnieje przewaga zawartości jonów wapnia oraz magnezu względem innych jonów dwuwartościowych.
W Polsce najczęściej twardość ogólną wyraża się w miligramorównoważnikach składnika nadającego twardość, znajdującego się w 1 dm3 wody (mval/dm3) lub w stopniach niemieckich, °n, 1°n = 10 mg CaO/dm3 wody. 1 mval/dm3 = 2,8°n.
Podział wód naturalnych ze względu na twardość można sklasyfikować w pięciu kategoriach:
- bardzo miękkie<1,5 mval/dm3,
- miękkie 1,5 - 3 mval/dm3,
- średnio twarde 3 - 6 mval/dm3,
- twarde 6 - 9 mval/dm3,
- bardzo twarde > 9 mval/dm3.
Oznaczenie twardości wody przeprowadza się najczęściej metodą kompleksometryczną za pomocą EDTA, stosując odpowiednie wskaźniki barwne.
Miareczkując roztwór przy pH = 10, w obecności czerni eriochromowej T, oznacza się twardość ogólną (sumę wapnia i magnezu), natomiast miareczkowanie przy pH = 12 wobec kalcesu lub mureksydu pozwala oznaczyć zawartość wapnia.
Celem oznaczenia jest określenie stopnia twardości wyciągu wodnego z odpadów metodą miareczkową.
Odczynniki:
- bufor amonowy o pH = 10,
- czerń eriochromowa T,
- 0,01 mol/dm3 roztwór EDTA.
Sprzęt laboratoryjny:
- cylinder miarowy o pojemności 25 cm³,
- kolby stożkowe o pojemności 250 cm³,
- biureta o pojemności 25 cm³,
- tryskawka,
- pipety.
Wykonanie oznaczenia twardości ogólnej według PN/C-4554.
Do kolby stożkowej odmierzyć pipetą 50 cm3 badanego roztworu, po czym dodać 2 cm3 buforu i wsypać bezpośrednio przed miareczkowaniem około 0,05 g mieszaniny czerni eriochromowej T. Miareczkować mianowanym roztworem EDTA o stężeniu 0,01 mol/dm3 do zmiany barwy z czerwono-fioletowej na niebieską, utrzymującej się 2 - 3 minuty. Pod koniec miareczkowania, w momencie pojawienia się zabarwienia fioletowego, roztwór EDTA dodawać ostrożnie, kroplami, mieszając energicznie zawartość kolby po dodaniu każdej kropli.
Obliczyć twardość ogólną ze wzoru:
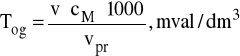
gdzie:
v - ilość EDTA zużytego na zmiareczkowanie próbki, cm3,
c - stężenie molowe EDTA, mol/dm3,
vpr - objętość próbki użytej do oznaczenia, cm3.
Wnioski
Otrzymane wyniki porównać z normami obowiązującymi w Polsce dla wody i ścieków.
1 f. OZNACZENIE ZAWARTOŚCI CHLORKÓW
Wszystkie wody naturalne zawierają określone ilości chlorków. Są one podstawowym anionem w wodach powierzchniowych, chociaż ich stężenie jest mniejsze niż siarczanów i węglanów. W rzekach i jeziorach zawartość chlorków wynosi zwykle od kilkunastu do kilkudziesięciu mg/ dm3. Chlorki zawarte w wodzie mogą pochodzić z gleby, z pokładów soli naturalnych oraz z zanieczyszczeń odpadami technologicznymi lub gospodarczymi.
Według wymagań sanitarno-higienicznych zawartość chlorków w wodzie do picia nie powinna przekraczać 200 mg/dm3, jeżeli są to chlorki pochodzenia geologicznego. Chlorki ze ścieków czynią wodę niezdatną do picia. W stężeniach >50 mg/ dm3 chlorki są niepożądane dla osób chorych na serce. Przy stężeniach > 250 mg/ dm3 chlorki są szkodliwe dla roślin.
Dopuszczalne stężenie chlorków dla wód powierzchniowych wynosi:
Klasa I - 250 mg/dm3,
Klasa II - 300 mg/dm3,
Klasa III - 400 mg/dm3.
Chlorki znajdujące się w ściekach pochodzą m.in. z:
wód naturalnych,
bytowania człowieka,
działalności gospodarczej i przemysłowej,
odcieków ze składowisk.
Chlorki obecne w odciekach są bardzo mobilne, nie są zatrzymywane przez grunt. Wzrost stężenia oznacza początek dopływu zanieczyszczonej masy wody. Powstałe na składowisku odpadów odcieki są kierowane systemem drenażowym do oczyszczalni ścieków.
Zgodnie z normą PN-75/C-04617/02 oznaczenie zawartości jonów chlorkowych w wodzie i ściekach przeprowadza się metodą miareczkowania argentometrycznego (metodą Mohra).
Metoda Mohra jest stosowana do oznaczeń chlorków w roztworach obojętnych lub słabo zasadowych (pH= 6,5 - 10). Pozwala ona uzyskać dobre wyniki, jeżeli zawartość chlorków jest większa od 2,5 mg/dm3.
Oznaczenie chlorków metodą Mohra
W wyniku reakcji chlorków z jonami srebra powstaje nierozpuszczalny chlorek srebra, który wytrąca się ilościowo.
![]()
Wprowadzenie niewielkiego nadmiaru jonów srebra w obecności jonów chromianowych jako wskaźnika powoduje utworzenie czerwono-brązowego chromianu(VI) srebra(I), który wskazuje punkt końcowy miareczkowania:
![]()
Utrzymanie pH w granicach od 5 do 9,5 w czasie miareczkowania umożliwia wytrącenie osadu. W oznaczaniu chlorków przeszkadzają jodki, bromki, węglany, fosforany, żelazo, siarczki, tiosiarczany i siarczany.
Celem oznaczenia jest określenie ilości chlorków w odcieku ze składowisk oraz określenie zdolności do wymywania chlorków z odpadów.
Odczynniki:
- 10% roztwór chromianu(VI) potasu,
- 0,1 mol/dm3 roztwór azotanu(V) srebra(I).
Sprzęt laboratoryjny:
- cylinder miarowy o pojemności 25 cm3,
- kolby stożkowe o pojemności 300 cm3,
- biureta o pojemności 25 cm3,
- tryskawka,
- pipety.
Wykonanie oznaczenia
Do kolby stożkowej odmierzyć pipetą 50 cm3 badanego roztworu, po czym dodać 1 cm3 roztwór chromianu(VI) potasu jako wskaźnika. Miareczkować dodając kroplami roztwór azotanu(V) srebra(I) do zmiany barwy z żółtej na mlecznobrunatną. Wykonać próbę kontrolną używając, zamiast wyciągu z odpadów, wody destylowanej.
Obliczyć zawartość chlorków na dm3 wyciągu ze wzoru:
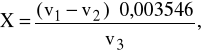
g ![]()
gdzie:
0,003546 g ![]()
odpowiada 1 cm3 0,1 n roztworu azotanu(V) srebra(I),
v1 - objętość azotanu(V) srebra(I)zużyta na zmiareczkowanie próbki, cm3,
v2- objętość azotanu(V) srebra(I)zużyta na zmiareczkowanie ślepej próby, cm3,
v3 - objętość wyciągu z odpadów wzięta do badania, dm3.
Przeliczenie na masę odpadów:
![]()
gdzie:
X - zawartość chlorków na litr wyciągu, g ![]()
/dm3,
v4 - objętość wyciągu uzyskana z odważki odpadów, dm3
m - masa odważki odpadów, kg.
Wnioski
Porównaj otrzymane wyniki z danymi literaturowymi.
Wyszukiwarka
Podobne podstrony:
odpady cwicz 3 4, Technologia chemiczna, 5 semestr, odpady
odpady cwicz 5, Technologia chemiczna, 5 semestr, odpady
program i zagadnienia do kolokwium, Technologia chemiczna, 5 semestr, odpady
II kolo materialy (1), Technologia chemiczna, 5 semestr, odpady
II kolo materialy (2), Technologia chemiczna, 5 semestr, odpady
odpady teoria kolokwium 1, Technologia chemiczna, 5 semestr, odpady
StacjonarneBAT pytania egzamin2013-KW, Uczelnia PWR Technologia Chemiczna, Semestr 6, BAT-y egzamin
Technologia chemiczna org-zagadnienia, Uczelnia PWR Technologia Chemiczna, Semestr 5, Technologia ch
spr cw 11, Technologia chemiczna, semestr 2, Fizyka, Laboratorium, laboratoria fizyka bincia
wyplyw cieczy ze zbiornika, Technologia chemiczna, 5 semestr, Podstawowe procesy przemysłu chemiczne
1(1), Technologia chemiczna, 5 semestr, analiza instrumentalna, sprawozdania
REAKCJA ALKILOWANIA IV-RZĘDOWYCH SOLI AMONIOWYCH, Uczelnia PWR Technologia Chemiczna, Semestr 5,
sprawozdanie1 cw.4, Technologia chemiczna, 5 semestr, analiza instrumentalna, sprawozdania
Cw9, Technologia chemiczna, 5 semestr, analiza instrumentalna, sprawozdania
strona tytułowa projektu inżynierskiego pwr, Uczelnia PWR Technologia Chemiczna, Semestr 7, Różne pr
CWGC, Technologia chemiczna, 5 semestr, analiza instrumentalna, sprawozdania
Wyniki II CC-DI kolokwium grudz 2009, Technologia chemiczna, semestr 2, Zarządzanie jakością i pro
więcej podobnych podstron