Mieczysław BŁASZCZYK i Magdalena FIT
Sukcesja Mikroorganizmów w czasie kompostowania odpadów organicznych
Streszczenie
Sukcesja mikroorganizmów w procesie kompostowania to następcza dominacja określonych gatunków i grup mikroorganizmów w związku ze zmianami temperatury w procesie tworzenia humusu z odpadów organicznych. W procesie kompostowania wyróżnia się cztery fazy zmian temperatury związane z sukcesją mikroorganizmów: faza mezofilna, w której następuje szybki rozwój mikroorganizmów, degradujących łatwodegradowalną materię organiczną. W następnej II fazie termofilnej temperatura może osiągać wartość 70-80 oC, rozwijają się mikroorganizmy typowo termofilne (bakterie, promieniowce i grzyby), zdolne do degradacji polimerycznej materii organicznej. W III fazie zwanej fazą schładzania, w której temperatura spada do 40 oC dominują fakultatywne termofile i termotolerancyjne. Wreszcie w ostatniej fazie (IV) formułowania się kompostu, dominują znów mikroorganizmy mezofilne.
1. Kompostowanie. Kompostowanie to suma procesów mikrobiologicznych zachodzących warunkach tlenowych związana z tworzeniem humusu jako końcowego produktu z odpadów organicznych [1]. Obok humusu w procesie utylizacji materii organicznej mikroorganizmy produkują duże ilości dwutlenku węgla uwalnianego do atmosfery oraz uwalniają znaczne ilości energii cieplnej w pryzmach kompostowych. W procesie mineralizacji materii organicznej obok produktu końcowego jakim jest humus uwalniane są mineralne związki azotu i fosforu. W czasie kompostowania tworzona jest także i to w znacznej ilości biomasa mikroorganizmów. Sumaryczna reakcja procesów zachodzących w procesie tlenowego rozkładu materii organicznej może być zapisana następująco [1]:
Materia organiczna + O2 + mikroorganizmy tlenowe ⇒
CO2 + NH4 + PO4 + biomasa mikroorganizmów + energia cieplna + humus
2. Zmiany temperatury w pryzmie kompostowej. Techniki kompostowania materii organicznej mają istotny wpływ na aktywność mikroorganizmów a tym samym na zmiany temperatury w kompoście [22]. Zwykle w procesie kompostowania biorą udział różne grupy mikroorganizmów zależnych temperaturowo [2]. Kompostowanie rozpoczyna faza początkowa (temperatura w zakresie od 25 do 45 oC) zwana mezofilną, związaną z szybkim wzrostem mikroorganizmów, wykorzystujących łatwodegradowalną materię organiczną - głównie cukry i aminokwasy.
W procesach metabolicznych mikroorganizmy uwalniają ciepło, podnosząc temperaturę w pryzmie aż do zahamowania ich aktywności.
Następna faza - termofilna (temperatura powyżej 45 oC) - w czasie następnych kilku dni temperatura na skutek aktywności mikroorganizmów termofilnych może dochodzić aż do
70-80 oC.
Faza termofilna ma istotny wpływ na zmianę i sukcesję populacji mikroorganizmów. Z jednej strony tak wysoka temperatura powoduje inaktywację, pozostanie w stadiach spoczynkowych oraz śmierć mikroorganizmów mezofilnych nieprzetrwalnikujących, z drugiej zaś tak wysoka temperatura faworyzuje wzrost i aktywność innych gatunków mikroorganizmów termofilnych.
Faza trzecia - zwana fazą schładzania - na skutek sukcesji mikroorganizmów termofilnych temperatura obniża się stopniowo do 40 oC. W tej fazie zachodzi głównie degradacja celulozy i hemicelulozy, w wyniku czego sucha masa kompostu staje się dwukrotnie niższa w czasie następnych kilkudziesięciu dni. Ostatnia - faza zimna - to okres stabilizacji kompostu, w którym mikroorganizmy termofilne tracą swoją aktywność a ponownie obserwowana jest aktywność mikroflory mezofilnej. W tej fazie dojrzewa kompost. Monitorowanie zmian temperatury jest dobrym narzędziem kontroli procesu kompostowania. W odpowiedniej temperaturze zachodzi w maksymalny sposób dekompozycja materii organicznej przez odpowiednie gatunki mikroorganizmów a powstały produkt końcowy jakim jest humus wolny jest od patogenów, organizmów niepożądanych w kompoście, nasion chwastów.
3. Zmiany ilościowe mikroorganizmów w czasie kompostowania. Aktualny skład mikroorganizmów zależy od surowca roślinnego poddawanego procesowi kompostowania
oraz warunków lokalnych. W
momencie rozpoczęcia kompostowania na roślinach znajduje się bardzo dużo gatunków bakterii (około 2000 gatunków). W gramie suchej masy kompostu liczba
grzybów około 150 tysięcy, podczas gdy w glebie ubogiej i żyznej odpowiednio 10 i 50 tysięcy;
bakterii około 400 mln w kompoście, 10 mln i 50 mln odpowiednio w glebie ubogiej i żyznej. W czasie kompostowania zmianie ilościowej ulegają bakterie mezofilne i termofilne, promieniowce oraz grzyby pleśniowe. Zmiany ilościowe i jakościowe mikroorganizmów jako funkcja temperatury przedstawione są w tabeli 1.
TABELA 1.
Liczba mikroorganizmów w 1 gramie kompostu [20].
Mikroorganizmy |
Faza mezofilna wstępna (< 40 oC) |
Faza termofilna (temp. 40-70 oC) |
Faza schładzania (od 70 oC do zimnej) |
Liczba gatunków (zidentyfikowane) |
Bakterie mezofilne termofilne |
108 104 |
104 108 |
1011 107 |
6 1 |
Promieniowce termofilne |
104 |
108 |
108 |
14 |
Grzyby mezofilne termofilne |
106 103 |
103 107 |
105 106 |
18 16 |
Wyniki prezentowane w tabeli wskazują na istnienie ścisłej korelacji pomiędzy ilościowym udziałem poszczególnych temperaturowo zależnych grup bakterii z jednej strony, z drugiej zaś obserwuje się dominację termofilnych promieniowców i grzybów w fazach termofilnej i schładzania.
W procesie kompostowania materii organicznej namnażają się bardzo licznie mikroorganizmy (Tab. 2). Ich liczba jest znacznie większa niż ich ilość podawana dla gleb. Zwiększona liczebność w szczególności dotyczy promieniowców, nadających charakterystyczny zapach kompostowi oraz grzybów pleśniowych.
TABELA 2.
Liczba mikroorganizmów po 29 dniach kompostowania oraz po następnych 9 dniach dojrzewania kompostu (w 1 gramie suchej masy kompostu) [2].
Reaktor |
Dni kompostowania |
Temp. oC inkubacji |
Mikroorganizmy |
||
|
|
|
Bakterie |
Promieniowce |
Grzyby |
II |
28 |
35 45 |
5 x 108 8 x 108 |
1 x 107 1 x 108 |
5 x 107 5 x 107 |
IV |
28 |
35 55 |
6 x 108 6 x 108 |
6 x 105 2 x 106 |
2 x 107 4 x 106 |
II |
37 |
20 45 55 |
9 x 109 2 x 109 1 x 109 |
4 x 108 2 x 106 4 x106 |
8 x 106 1 x 107 2 x 105 |
IV |
37 |
20 45 55 |
1 x 109 1 x 109 8 x 108 |
6 x 109 1 x 109 2 x 106 |
2 x 108 5 x 105 3 x 108 |
4. Aktywność metaboliczna w poszczególnych fazach kompostowania materii organicznej. Poniższy Rys. 1 jest kompilacją wyników podawanych przez kilku autorów [7, 18, 21, 23] a dotyczące tempa wydzielania dwutlenku węgla, tempa pobierania tlenu oraz spadku biomasy w czasie kompostowania w zależności od temperatury. Wyniki te naniesione jako punkty wskazują niezbicie, że najwyższe aktywności metaboliczne mikroorganizmów obserwowane są w temperaturze optymalnej dla większości mikroorganizmów termofilnych, zbliżonej do 60 oC. W tej bowiem temperaturze wszystkie wskaźniki metaboliczne osiągają wartości zbliżone do wartości 1.0. Asymilacja węgla oraz wydzielanie dwutlenku węgla przebiega z różną szybkością u różnych grup mikroorganizmów. Zdaniem Alexander [1] w czasie kompostowania bakterie asymilują od 5 do 10% węgla organicznego, promieniowce od 15 do 30% a grzyby od 30-40% węgla dostępnego w biomasie organicznej. Tak więc wśród mikroorganizmów najwyższą aktywnością charakteryzują się grzyby. Chang i Hudson [5] stwierdzili że tak wysoka aktywność przypisywana jest grzybom Chaetomium theromphilum oraz Humicola insolens, gatunki odpowiedzialne za degradację celulozy w temperaturze optymalnej dla termofili. Obok nich w temperaturze 55-61 oC rozwija się Aspergillus fumigatus, bardzo aktywnie degradujących celulozę [19].
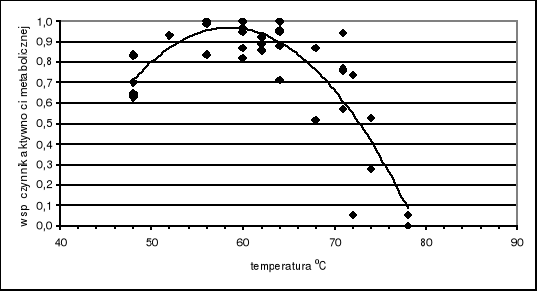
Rys. 1. Zmiany aktywności metabolicznej mikroorganizmów w zależności od temperatury
w procesie kompostowania.
Zdanie to podziela wielu badaczy, którzy twierdzą że produkcja ciepła (>60 do 65 oC) w masie kompostowej jest konieczna nie tylko do pasteryzacji, ale jest czynnikiem decydującym obok napowietrzania dla głębszej dekompozycji materii organicznej [12]. Odmiennego zdania są McKinley i Vestal [14], którzy twierdzili, że w procesie kompostowania osadów ściekowych komunalnych maksymalna aktywność mikroorganizmów była obserwowana w zakresie temperatur od 25 do 45 oC, podczas gdy w temperaturach w zakresie od 55 do 74 oC notowali relatywnie niższą aktywność. Te odmienne obserwacje są prawdopodobnie wynikiem zróżnicowanego składu kompostowanej materii organicznej, metody kompostowania a przede wszystkim doborem adekwatnych metod ilościowych pozwalających na oszacowanie aktywności i biomasy mikroorganizmów. Zdaniem McKinley i Vestal [14] takie odmienne spojrzenie daje metoda mierzenia szybkości włączania [14C]octanu do frakcji lipidów mikroorganizmów. Metoda ta koreluje z ubytkiem masy, tempem oddychania oraz heterotroficznym wiązaniem dwutlenku węgla.
5. Sukcesja mikroorganizmów w procesie kompostowania. Strom [19] podaje listę mikroorganizmów sukcesywnie pojawiających się w procesie kompostowania materii organicznej jako następstwo zmian temperatury.
Tabela 3.
Mikroorganizmy występujące w czasie kompostowania materii organicznej ([19], nazwy zgodne z aktualnym stanem zmienione przez autora tekstu oraz wprowadzono dodane nowe gatunki)
Bakterie właściwe |
Promieniowce |
Grzyby |
Bacillus circulans Bacillus coagulans Bacillus licheniformis Bacillus sphaericus B. stearothermophilus B. subtilis Bacillus sp. Clostridium thermocellum Clostridium sp. Micrococcus sp.
Pseudomonas fluorescens Pałeczki i ziarniaki |
Micropolyspora faeni Nocardia brasilensis Nocardia sp. Pseudonocardia thermophila Streptomyces rectus Streptomyces thermofuscus Streptomyces thermophilus Streptomyces thermoviolaceus Streptomyces violaceus-ruber Streptomyces sp. Thermoactinomyces vulgaris Thermoactinomyces sacchari Thermoactinomyces sp Thermobispora bispora Thermomonospora chromogena. Thermomonospora curvata Thermomonospora viridis Thermomonospora sp. |
Absidia corymbifera Absidia ramosa Absidia sp. Aspergillus fumigatus Aspergillus niger Byssochlamys sp. Chaetomium thermophile Coonemeria crustacea Coprinus lagopus Coprinus cinereus Coprinus sp. Corynascus thermophilus Dactylomyces crustaceous Dactylomyces thermophilus Humicola insolens Humicola stellata Lenzites sp. Malbranchea pulchella Malbranchea sulfurea Mortierella turficola Myceliophthora thermophila Myriococcum albomyces Myriococcum thermophilum Papulaspora thermophila Rhizomucor miehei Rhizomucor pussilis Rhizomucor sp. Scopulariopsis brevicaule Scytalidium thermophilum Sporotrichum thermophile Stilbella thermophila Talaromyces dupontii Talaromyces emersonii Talaromyces thermophilus Thermoascus aurantiacus Thermoidium sulfureum Thermomyces lanuginosus Thermomyces stellatus Thielavia terrestris Torula thermophila |
Lista powszechnie występujących populacji bakterii, w tym promieniowców oraz grzybów w powyższej tabeli nie wydaje się zamknięta. Skład gatunkowy oraz liczba poszczególnych populacji zależna jest nie tylko od rodzaju materii organicznej poddawana kompostowaniu, ale także od technologii kompostowania. Podana lista mikroorganizmów, to populacje dominujące i subdominujące. Zwykle wiele gatunków podanych w tabeli to rezydenci powierzchni roślin, resztek roślinnych, powierzchni nasion, pasz zwierzęcych itd. W wiekszości technologii kompostowania mikroorganizmy rezydujące oraz znajdujące się przypadkowo stanowią inoculum procesu humifikacji materii organicznej.
Sukcesja mikroorganizmów rozumiana jako zmiany składu ilościowego i jakościowego populacji mikroorganizmów warunkowana jest zmianami temperatury w czasie kompostowania. Wyróżnia się trzy grupy mikroorganizmów: (1) psychrofilne, (2) mezofilne oraz (3) termofilne. Mikroorganizmy psychrofilne rosną w temperaturze nie wyższej niż 20 oC, a temperaturą optymalna dla wzrostu w zależności od gatunku mieszczącą się w zakresie od 4 do 15 oC. Ta grupa mikroorganizmów wydaje się być istotna w procesie kompostowania materii organicznej na terenach Kanady i Północnych Stanach Ameryki. Druga grupa mikroorganizmów zaliczana do grupy mezofilnych rośnie w temperaturze niższej niż 45 oC. Dla większości gatunków środowiskowych mezofilnych temperatura optymalna dla wzrostu i rozwoju waha się od 25 do 35 oC. Mikroorganizmy termofilne rozwijają się w temperaturze powyżej 45 oC aż do temperatury wrzenia wody lub stanu jej skupienia, w której woda występuje w stanie ciekłym. Przez wiele lat sądzono, że mikroorganizmy termofilne mogą rosnąć w zakresie od 45 do 80 oC. Izolacje z środowisk skrajnych (źródeł gorących, gorących kominów hydrotermalnych) dowodzą, że wiele gatunków bakterii oraz archeony metanogenne zdolne są do wzrostu w temperaturze powyżej 100 oC. Grupa mikroorganizmów rosnąca w zakresie temperatury powyżej 80 oC zwana ekstremotermofilami nie uczestniczy w procesie kompostowania materii organicznej, a jedynie bardzo aktywna metabolicznie grupa termofili rosnąca w zakresie od 45 do 60 oC.
5.1. Bakterie właściwe. W fazie ciepłej (mezofilnej) w kompoście dominują bakterie heterotroficzne należące do następujących rodzajów: Pseudomonas (P. aureofaciens, P. fluorescens, P. putida, P. stutzeri, P. paucimobilis), Achromobacter, Acinetobacter (A. junii, A. lwoffi), Bacillus, Cellulomonas, Commomonas (C. acidovorans), Clostridium, Flavobacterium (F. multivorum), Staphylococcus oraz autotroficzne bakterie nitryfikacyjne [15]. W fazie termofilnej w zakresie temperatury od 49 do 65 oC wśród bakterii dominują gatunki należące do rodz. Bacillus (ponad 85%). W temperaturze 49-55 oC wśród gatunków należących do rodz. Bacillus dominują B. coagulans (typ A i typ B) oraz B. circulans. Podniesienie temperatury w zakresie 55-65 oC powoduje zmianę dominacji gatunków należących do rodz. Bacillus. W tym zakresie temperatury dominują szczepy należące do gatunków B. stearothermophilus, B. coagulans (typ A), B. brevis i B. sphaericus, przy czym z tym zakresie temperatury zdecydowanie dominuje B. stearothermophilus [19]. W wyższej temperaturze (optimum przy 70 oC) w kompoście dominuje Caldibacillus cellulovorans, zdolny do bardzo efektywnej degradacji celulozy [4]. Haruta i wsp. [8] analizując zmiany składu mikroflory w procesie kompostowania materii organicznej z zastosowaniem technik molekularnych (z zastosowaniem techniki DGGE oraz metody FISH) stwierdzili, że za degradację materii w warunkach termofilnych (w temperaturze około 45-50 oC przez 18 dni) odpowiedzialne są następujące gatunki bakterii należace do rodz. Bacillus: B. thermosphaericus, B. thermoamylovorans, B. licheniformis, które stanowiły około 30-40% wszystkich bakterii właściwych przy ogólnej liczbie tworzących kolonie wynoszącej 1010 w gramie mokrego kompostu. Prawie wszystkie dominanty mogą rosnąć także w warunkach beztlenowych w zakresie temperatur dla mezofili i termofili. Grupa ta jest odpowiedzialna za degradację cukrów prostych do prostych kwasów organicznych oraz hydrolizę skrobi. Z wyjątkiem B. circulans żaden z pozostałych dominantów nie jest zdolny do rozkładu celulozy i pektyny.
Beffa i wsp. [3] z prób kompostu pobranych w temperaturze powyżej 60 oC wyizolowali szczepy bakterii zdolne do utleniania siarki i wodoru w procesie autotroficznego wzrostu. Bakterie te będące obligatoryjnymi chemolitoautotrofami, niesporujące, zostały zaklasyfikowane do rodzaju Hydrogenobacter, dotychczas znajdowany w gorących źródłach hydrotermalnych. Rosną one w zakresie temperatur od 60 do 80 oC, z optimum przy 70-75 oC. Autorzy Ci wyizolowali także sporujące, gram-zmienne, fakultatywne chemolitotrofy, rosnące w temperaturze w zakresie od 55 do 75 oC, z optimum przy 65-70 oC. Szczepy te zostały zaklasyfikowane jako Bacillus schlegelli. Jest to pierwsze doniesienie, że termofilne komposty są siedliskiem bakterii zdolnych do utleniania wodoru oraz siarki obok powszechnie opisywanego typowo heterotroficznego gatunku Bacillus stearothermophilus.
Ishii i wsp. [9] prowadzili badania zmian sukcesji bakterii (bakterii właściwych) w procesie kompostowania odpadów pochodzących z restauracji w warunkach laboratoryjnych. W oparciu o analizę DNA izolowanego bezpośrednio z próbek kompostu z zastosowaniem rozdziału DNA w linearnym gradiencie żelu denaturującego (z zastosowaniem mocznika i formamidu) stwierdzono odmienny skład gatunkowy bakterii w poszczególnych fazach kompostowania. W fazie zwanej S (gdzie temperatura kompostu w czasie 4 dni podniosła się z 25 do 48 oC) w temperaturze sprzyjającej rozwojowi mezofili stwierdzono obecność bakterii fermentujących takich jak: Leuconostoc paramesenteroides, Pediococcus acidilactici, Staphylococcus piscifermentans, wydzielające do środowiska kompostu kwasy organiczne, głównie kwas mlekowy, mimo że kompostowanie przebiegało w warunkach tlenowych. Obok nich w próbach stwierdzono obecność laseczek zarodnikujących należących do Bacillus coagulans i Bacillus badius. W fazie T - termofilnej (4 - 13 dni), w której temperatura maksymalna wynosząca 58 oC została zanotowana w 9 dniu kompostowania stwierdzono obecność następujących gatunków bakterii: Bacillus coagulans, Bacillus Badius, Bacillus sp. oraz Virdibacillus proomii, Gracilibacillus halotolerans należące do Bacillaceae a także Corynebacterium urealyticum. W fazie C - schładzania (13-24 dni kompostowania), w czasie której temperatura spadła z 52 do 30 oC występowały gatunki bakterii zaliczane do Sphingobacterium multivorum (z typu Cytophaga-Flavobacterium), Alloiococcus otitis, Clostridium fervidus, Clostridium filimentosum (z Clostridiaceae) oraz Alcaligenes sp. W fazie M - formułowania kompostu (od 32 do 45 dnia), gdzie temperatura kompostu była niższa niż 30 oC obserwowano obecność gatunków należących do Arthrobacter.
Tabela 4.
Podobieństwa sekwencji prążków DNA w linearnym gradiencie żelu denaturującego w próbach w czasie procesu kompostowania odpadów organicznych z restauracji ( [9], uproszczone)
Gatunek (%) |
Próby pobrane w czasie kompostowania w dniach |
|||||||||
|
4 |
9 |
13 |
20 |
24 |
28 |
32 |
38 |
43 |
45 |
Staphylococcus piscifermentans (99.1) Leuconostoc paramesenteroides (97.4) Pediococcus acidilactici (98.2) Bacillus badius (99.3) Bacillus sp. (99.1) Virgibacillus proomii (94.7) Corynebacterium urealyticum (95.3) Gracilibacillus halotolerans (94.4) Clostridium filimentosum (85.6) Alcaligenes sp. (91.4) Alloiococcus otitis (90,0) Clostridium fervidus (88.2) Sphngobacterium multivorum (83.4) Arthrobacter sp. (86.4) |
++ + + + + ++ +
|
+ +++ +
|
++
++ ++ ++
|
+ + + |
+ ++ ++ + + |
+ ++ + + ++ |
+ ++ + ++ ++ |
+ ++ + + ++ |
+ ++ + + ++ + |
+ ++
++ ++ ++ |
5.2. Promieniowce. Obok gatunków promieniowców podawanych w tabeli 3 w kompoście znajdowane są gatunki należące do następujących rodzajów [11]: Actinomadura, Amycolata, Amycotopsis, Micromonospora, Microtetraspora, Nocardiopsis, Promicromonospora, Saccharotrhix, Streptomyces, Sacharomonospora, Saccharopolyspora, Thermoactinomyces, Thermomonospora, Thermocrispum.
W procesie powstawania kompostu pieczarkowego obserwowano także bioróżnorodność i sukcesję gatunków promieniowców [11]. Podstawą kompostu pieczarkowego jest słoma, która zawiera liczne gatunki promieniowców należących do następujących rodzajów: Saccharopolyspora rectivirgula (42%), Saccharomonospora (14%), Streptomyces albus (19%), Streptomyces griseus (36%), Streptomyces sp. (28%). Słoma jest odpowiednio mieszana z nawozem końskim, i jeśli tego wymaga sytuacja dodaje się pierwiastki biogenne oraz gips. I faza kompostowania odbywa się poza pomieszczeniem do hodowli pieczarek, zwykle na powietrzu w postaci pryzmy kompostowej. Temperatura kompostu osiąga wartość nawet 75-80 oC a sam proces przebiega od tygodnia do 10 dni. Następnie kompost jest przenoszony do pomieszczenia lub tunelu, w którym prowadzi się hodowlę pieczarek. Temperatura kompostu obniża się do 60 oC a kompost jest dodatkowo napowietrzany powietrzem wzbogaconym w tlen (15-20%). W tej temperaturze następuje formułowanie kompostu przez następne 3-10 dni. Po schłodzeniu do kompostu dodaje się zarodniki pieczarki.
TABELA 5.
Zamiana składu ilościowa i jakościowa populacji promieniowców w procesie tworzenia kompostu pieczarkowego (wg Lacey, 1997)
Promieniowce |
Cfu x 104 /gram suchej masy kompostu |
|||
|
koniec I fazy |
II faza |
koniec II fazy |
po inokulacji zarodnikami pieczarki |
Saccharomonospora sp. Saccharopolyspora sp. S. rectivirgula Streptomyces sp. Thermoactinomyces sp. Thermomonospora sp. T. chromogena Inne |
0.8 6.4 - 19.1 7.8 15.2 14.4 4.2 |
0.4 5.6 - 24.3 16.5 54.4. 60.5 9.9 |
4.3 0.1 0.2 24.7 4.7 48.1 72.4 17.1 |
- 7.0 - 7.9 13.1 7.0 72.3 34.9 |
W pierwszej fazie dominują gatunki promieniowców zaliczane do rodz. Streptomyces tworzące grzybnię powietrzną, rodz. Micromonospora oraz Thermoactinomyces i Thermomonospora, z dominacją gatunku T. chromogena. Największe liczebności promieniowców obserwowane były w kompoście w temperaturze około 50 oC i osiągały wartości 12 x 109 w gramie mokrego kompostu. Gdy temperatura kompostu osiągnęła temperaturę 65 oC liczebność promieniowców znacznie spadla, ale występowały promieniowce, które rosły także w temperaturze 28 oC a żaden w temperaturze 75 oC. W II fazie, gdzie formułowanie kompostu odbywało się w temperaturze 60 oC dominowały gatunki typowo termofilne zaliczane do rodz. Thermomonospora (T. chromogena) oraz rodz. Streptomyces. Po rozsianiu zarodników pieczarki w kompoście także dominowała Thermomonospora chromogena. Zdaniem Wiegant [24] II fazie dominuje termofilny grzyb Scytalidium thermophilum, bez którego nie byłoby odpowiedniego kompostu do hodowli pieczarek
a jego obecność oraz Myriococcum thermophilum zdaniem Straatsma i wsp. [17] podwaja plon pieczarek. Rola promieniowców w procesie kompostowania jest bardzo istotna. Jest to grupa mikroorganizmów, która uczestniczy w degradacji lignocelulozy, biorąc udział nie tylko w degradacji celulozy, ale także lignin, obok grzybów prowadzących proces butwienia drewna.
5.3. Grzyby. W tabeli 3 przedstawione są gatunki grzybów, które powszechnie występują w czasie kompostowania materii organicznej. W istocie jest ich znacznie więcej. Z listy 39 gatunków występujących w różnych kompostach wszystkie mogą rosnąc i rozwijać się w zakresie temperatur od 20 do 45 oC, przy czym w temperaturze 45 oC dominują Aspergillus fumigatus i Rhizomucor pusillus. W temperaturze powyżej 55 oC tylko kilka gatunków: Chaetomium thermophile, Coonemeria crustacea, Coprinus cinereus, Malbranchea pulchella, Rhizomucor pussilus, Scytalidium thermophilum, Talaromyces thermophilus, Thermoascus aurantiacus, Thermomyces lanuginosus. Zdaniem Klamer i Sochting [10] w piku temperaturowym dominują grzyby termofilne i termotolerancyjne należące do Thermomyces lanuginosus, Scytalidium thermophilum i Poecilomyces variotti oraz Coprinus cinereus. Nielsen i wsp. [16] twierdzą, że w fazie termofilnej kompostu dominował Aspergillus fumigatus. Aspergillus fumigatus w postaci zarodników zdaniem Danneberg i wsp. [6] w dużej ilości pojawia się w powietrzu wokół kompostowni i jest przyczyną schorzeń układu oddechowego. Jaka jest rola grzybów w procesie kompostowania materii organicznej? Grzyby termofilne i termotolerancyjne wytwarzają wiele enzymów wydzielanych pozakomórkowo (amylazy, lipazy, celulazy, proteazy, ksylanazy, pektynazy, fosfatazy) istotnych w procesach degradacji materii organicznej [13]. Warto tutaj dodać, że specyficzna szybkość wzrostu jednego z dominantów fazy termofilnej Thermomyces lanuginosus w temperaturze 50 oC wynosi 0.23 x godz-1, podczas gdy w temperaturze mezofilnej (30 oC) tylko 0.06 x godz -1 [11].
6. Podsumowanie. W procesie kompostowania materii organicznej oraz tworzenia humusu kluczową rolę odgrywają mikroorganizmy (bakterie, w tym promieniowce oraz grzyby). Pewną rolę w tworzeniu humusu przypisuje się także zwierzętom bezkręgowym. Mikroorganizmy obecne w procesie kompostowania wykorzystują odpady organiczne jako pokarm (źródło węgla i energii). Część materii odpadowej zostaje przy ich udziale spalona w procesach mikrobiologicznych do dwutlenku węgla (50%), część zostaje zasymilowana i związana z wytworzeniem biomasy mikroorganizmów (do 30% masy), pozostała to trudnorozkładalna materia, z której powstają związki wchodzące w skład humusu. Można tutaj wyraźnie podkreślić, że mikroorganizmy tym samym biorą udział w procesach usuwania i mineralizacji materii organicznej (która stanowi wtórnie zanieczyszczenie środowiska) z wytworzeniem pełnowatościowego nawozu naturalnego. Zadaniem biotechnologów wykorzystujących mikroorganizmy do kompostowania materii organicznej odpadowej jest opracowanie takich technologii, aby powstałe w procesach mikrobiologicznych produkty były nie tylko gospodarczo użyteczne, ale bezpieczne z sanitarnego punktu widzenia.
7. LITERATURA
[1] ALEXANDER M.. Introduction to Soil Microbiology. 2nd ed. John Wiley & Sons, New York (1977).
[2] BAGSTAM G. Population changes in microorganisms during composting of spruce bark. I. Influence of temperature control. Europ. J. Appl. Microbiol. Biotechnol., 5: 315-330 (1978).
[3] BEFFA T., Blanc M., Aragno M. Obligately and facultatively autotrophic, sulfur- and hydrogen-oxidizing thermophilic bacteria isolated from hot composts. Archiv. Microbiol. 165: 34 - 40 (1996).
[4] BERGQUIST P.L., Gibbs M.D., Morris D.D., Teo V.S.J., Saul D.J., Morgan H.W. Molecular diversity of thermophilic cellulolytic and hemicellulolytic bacteria. FEMS Microbiol.. Ecology, 28: 99-110 (1999).
[5] CHANG Y., Hudson H.J. The fungi of wheat straw compost. I. Ecological studies. Trans. Br. Mycol. Soc. Hortic., 50: 2: 249-256 (1967).
[6] DANNEBERG G., Gruneklee E., Seitz M., Hartung J., Driesel A.J. Microbial and endotoxin immisions in the neighborhood of a composting plat. Ann. Agric. Environ. Med., 4: 169-173 (1997).
[7] FINSTEIN M.S., Morris M.L. Microbiology of municipal solid waste composting. Advan. Appl. Microbiol., 19: 113-151 (1975)
[8] HARUTA S., Kondo M., Nakamura K., Aiba H., Ueno S., Ishii M., Igarashi Y. Microbial community changes during organic solid waste treatment analyzed by double gradient-denaturating gradient gel electrophoresis and fluorescence in situ hybridization. Appl. Microbiol. Biotechnol., 60: 224-231 (2002).
[9] ISHII K., Fukui M., Takii S. Microbial succession during a composting process as evaluated by denaturing gradient gel electrophoresis analysis. J. Appl. Microbiol., 89: 768-777 (2000).
[10] KLAMER M, Søchting U. Fungi in a controlled compost system - with special emphasis on the thermophilic fungi. Acta Horticulturae 469: International symposium on composting & use of composted material in horticulture. Ayr, Scotland, United Kingdom, July 1998.
[11] LACEY J. Actinomycetes in compost. Ann. Agric. Environ. Med. 4: 113-121 (1997).
[12] MACGREGOR S.T., Miller F.C., Psarianos K.M., Finstein M.S. Composting process control based on interaction between microbial heat output and temperature. Appl. Environ. Microbiol. 41:1321-1330 (1981).
[13] MAHESHWARI R., Bharadwaj G., Bhat M.K. Thermophilic fungi: their physiology and enzymes. Microbiol. Mol. Biol. Rev., 64: 461-488 (2000).
[14] MCKINLEY V.L., Vestal J.R. Biokinetic analyses of adaptation and succession: microbial activity in composting municipal sewage sludge. Appl. Environ. Microbiol., 47: 933-941 (1984).
[15] MARTINOTTI M.G., Puppo M., Varese G.C., Gautier E., Bertolotto A. Phenotypic and functional characterization of the microbial communities isolated from a compost. Proceedings Sardinia 99, Seventh International Waste Management and Landfill Symposium, S. Margherita di Pula, Cagliari, Italy, 4-8 October 1999.
[16] NIELSEN R.H., Wurtz H., Breum N.O., Poulsen O.M. Microorganism and endotoxin in experimentally generated bioaerosols from composting household waste. Ann. Agric. Environ. Med., 4: 159-168 (1997).
[17] STRAATSMA G., Olijnsma T.W., Gerrits J.P.G., Amsing J.G.M., Op Den Camp H.J.D., van Griensven L.J.L.D. Inoculation of Scytalidium thermophilum in button mushroom compost and its effect on yield. Appl. Environ. Microbiol., 60: 3049-3054 (1994).
[18] STROM P.F. The thermophilic bacterial populations of refuse composting as affected by temperature Ph.D. Thesis. Rutgers University, New Brunswick, NJ (1978).
[19] STROM P.F. Effect temperature on bacterial species diversity in thermophilic solid-waste composting. Appl. Environm. Microbiol., 50: 899-905 (1985).
[20] SYLVIA D. M., Fuhrmann J. J. Principles and applications of soil microbiology . New Jersey, Prentice Hall, Inc (1999).
[21] ROTHBAUM H.P. Heat output of thermophiles occurring on wool. J. Bacteriology, 81: 165-171. (1961).
[22] TAIWO L.B., Oso B.A. Influence of composting techniques on microbial succession, temperature and pH in a composting municipal solid waste. African J. Biotechnol., 4: 239-243 (2004).
[23] WILEY J.S. III. Progress report of high rate composting studies. Proc. Ind. Waste Conf., 12: 596-603. (1957).
[24] WIEGANT W. M. Growth characteristics of the thermophilic fungus Scytalidium thermophilum in relation to production of mushroom compost. Appl Environ. Microbiol., 58: 1301-1307 (1992).
Mieczysław Błaszczyk
Instytut Mikrobiologii UW
ul. Miecznikowa 1
02-096 Warszawa
m.blaszczyk@biol.uw.edu.pl
Magdalena Fit
Polska Izba Gospodarki Odpadami
ul. Złota 44/46
00-120 Warszawa
biuro@pigo.org.pl
Wyszukiwarka
Podobne podstrony:
kompostowanie odpadow organicznych, Studia pomieszany burdel, UNIESZKODLIWIANIE PROJEKT DANE
Wyznaczanie współczynnika przewodnictwa cieplnego, Studia pomieszany burdel, FIZA EGZAMIN, FIZYKA-sp
Sprawdzanie twierdzenia Steinera za pomocą wahadła fizycznego, Studia pomieszany burdel, FIZA EGZAMI
mata1, Studia pomieszany burdel, Matematyka
Pomiar oporu przewodników, Studia pomieszany burdel, FIZA EGZAMIN, FIZYKA-sprawozdania
Hydro Ściąga, Studia pomieszany burdel, Hydrologia
zestawy zadan z kondycjonowania i odwadniania, Studia pomieszany burdel, osady, materiayzzaj
95 96, Studia pomieszany burdel, FIZA EGZAMIN
57, Studia pomieszany burdel, FIZA EGZAMIN, FIZYKA-sprawozdania, Widmo Absorpcji57
65, Studia pomieszany burdel, FIZA EGZAMIN
Fizyka wejsciowki 2, Studia pomieszany burdel, FIZA EGZAMIN, FIZYKA-sprawozdania
Pomiar współczynnika napięcia powierzchniowego cieczy metodą rurek włoskowatych, Studia pomieszany b
więcej podobnych podstron