Wydział: IiTCh |
Janusz Budzowski Marek Budziaszek Robert Woloszyn Łukasz Krężel |
Data: 12.01.2002 |
|
gr.34 |
|
Ocena: |
|
Zespół 2 |
Ćwiczenie 2 |
Temat:
Wyznaczanie stałej równowagi metodą podziału Nernsta dla reakcji |
|
1. Wstęp teoretyczny
Termodynamiczna stała równowagi opisuje stan, w którym prędkości procesów
biegnących w przeciwnych kierunkach są sobie równe, a zmiana potencjału termodynamicznego ΔG = 0. Przyjmuje ona wartość stałą w stałej temperaturze i pod stałym ciśnieniem. Zależność stałej od temperatury opisuje izobara Van't Hoffa:
![]()
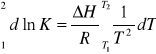
![]()
Dla małych zakresów temperatur zmiany entalpii ΔH traktujemy jako stałą i wyciągamy
przed znak całki. W przypadku szerokiego zakresu zmienności temperatury zmiana entalpii ΔH zależy od temperatury i należy ją całkować w zadanych granicach.
Jeżeli ΔH większe od zera i proces jest endotermiczny stała rośnie wraz ze wzrostem
temperatury oraz wzrasta wydajność procesu.
Dla ΔH mniejszego od zera i procesu egzotermicznego wzrost temperatury powoduje
spadek wydajności tworzenia produktu na rzecz tworzenia substratów.
Doświadczenie opiera się na reakcji ![]()
. Stała termodynamiczna dla tej reakcji ma
postać: 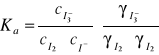
.
a ponieważ powyższy wzór nie uwzględnia cech charakterystycznych jonów, więc współczynniki aktywności tych jonów, w tym samym roztworze, są sobie równe. Wynika z tego, że wyrażenie 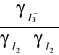
= 1, i że stała stężeniowa reakcji jest w przybliżeniu równa stałej termodynamicznej: Ka ![]()
Kc
Reakcja prowadzimy w środowisku wodnym i niewodnym (CCl4), w których stężenia jodu
są różne. Po ustaleniu się stanu równowagi oznacza się zawartość jodu w mieszaninach reakcyjnych przez miareczkowanie roztworem tiosiarczanu sodu. Miareczkując warstwę wodną oznacza się całkowitą zawartość jodu, sumę I2 i ![]()
, ponieważ jony ![]()
są nietrwałe i ulegają rozpadowi w czasie miareczkowania:
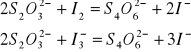
Natomiast przez miareczkowanie warstwy niewodnej oznacza się stężenie I2 w CCl4 w stanie równowagi z I2 w fazie wodnej. Następnie oblicza się równowagowe stężenia poszczególnych reagentów, wykorzystując do tego celu współczynnik podziału jodu między warstwę wodną i CCl4.
2. Cel ćwiczenia
Celem ćwiczenia jest wyznaczenie stałej równowagi reakcji ![]()
w roztworze
wodnym na podstawie wyników miareczkowania i współczynnika podziału jodu między wodę i czterochlorek węgla.
3. Zadanie
Sporządzono następujące roztwory:
0.1 molowy roztwór KI, który rozcieńczono aby uzyskać 0.01 molowy,
0.01 molowy roztwór tiosiarczanu sodu
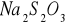
,
1% roztwór skrobi według przepisu: 1g skrobi + 20cm³ H2O + 80cm³ ciepłej H2O.
Kolbkę zawierającą, uprzednio wytrząśniętą, mieszaninę nasyconego roztworu I2 w CCl4 i
0,01 molowego wodnego roztworu KI umieszczono w termostacie na pół godziny w celu osiągnięcia przez układ zadanych temperatur. W drugiej kolbie sporządzono mieszaninę nasyconego roztworu I2 w CCl4 i 0,01molowego roztworu KI. Kolbę wytrząsano przez 20 minut w celu doprowadzenia układu do stanu równowagi chemicznej, fizycznej i termodynamicznej. Następnie pobrano z pierwszej kolbki po około x cm3 warstwy niewodnej i po o y cm3 warstwy wodnej (próbki pobierano od razu z obydwu warstw, aby zachować temperaturę reakcji). Do warstwy niewodnej dodano ok. 10 cm3 0,1 molowego roztworu KI i miareczkowano 0,01 molowym roztworem tiosiarczanu sodu. Pod koniec miareczkowania dodano do roztworu 2 cm3 skrobi i prowadzono miareczkowanie do całkowitego odbarwienia się roztworu. Warstwę wodną miareczkowano bezpośrednio roztworem tiosiarczanu wobec skrobi, również do odbarwienia się roztworu. Analogicznie postąpiono z kolbką drugą, w której znajdowała się mieszanina w temperaturze pokojowej. Wyniki miareczkowania przedstawiono w tabeli.
Doświadczenia przeprowadzano w różnych temperaturach. Uzyskane próbki z
poszczególnych warstw miareczkujemy roztworem 0.01 molowym ![]()
w obecności skrobi jako wskaźnika aż do odbarwienia.
Stała podziału dla odpowiednich temperatur:
KN (18°-25°) I2 między CCl4 a H2O = 85
KN (25°-35°) I2 między CCl4 a H2O = 95
Stężenie tiosiarczanu jest stałe dla wszystkich przeprowadzonych serii doświadczeń:
cNa2SO3= 0.01 mol/dm3
18oC
|
|
w. wodna [cm³] |
w. wodna [cm³] |
w. organiczna [cm³] |
w. organiczna [cm³] |
|
Vfazy [cm3] |
15 |
15 |
2 |
2 |
|
VNa2S2O3 [cm3] |
12.2 |
11.9 |
25.05 |
24.8 |
|
CI2 w fazie |
0.004 |
0.062 |
||
Wartość średnia CI2 w fazie |
0.004 |
0.062 |
|||
20oC
|
|
w. wodna [cm³] |
w. wodna [cm³] |
w. organiczna [cm³] |
w. organiczna [cm³] |
|
Vfazy [cm3] |
10 |
10 |
4 |
4 |
|
VNa2S2O3 [cm3] |
1.0 |
0.8 |
4.7 |
4.2 |
|
CI2 w fazie |
0.015 |
0.012 |
||
Wartość średnia CI2 w fazie |
0.00045 |
0.0556 |
|||
21oC
|
|
w. wodna [cm³] |
w. wodna [cm³] |
w. organiczna [cm³] |
w. organiczna [cm³] |
|
Vfazy [cm3] |
10 |
10 |
2 |
2 |
|
VNa2S2O3 [cm3] |
8.5 |
8.6 |
25.4 |
24.0 |
|
CI2 w fazie |
0.0043 |
0.00625 |
||
Wartość średnia CI2 w fazie |
0.0043 |
0.00625 |
|||
22oC
|
|
w. wodna [cm³] |
w. wodna [cm³] |
w. organiczna [cm³] |
w. organiczna [cm³] |
|
Vfazy [cm3] |
10 |
10 |
2 |
2 |
|
VNa2S2O3 [cm3] |
10 |
10 |
29.5 |
29.5 |
|
CI2 w fazie |
0.005 |
0.0737 |
||
Wartość średnia CI2 w fazie |
0.005 |
0.0737 |
|||
30oC
|
|
w. wodna [cm³] |
w. wodna [cm³] |
w. organiczna [cm³] |
w. organiczna [cm³] |
|
Vfazy [cm3] |
10 |
10 |
2 |
2 |
|
VNa2S2O3 [cm3] |
8.4 |
8.6 |
24.4 |
24.4 |
|
CI2 w fazie |
0.00425 |
0.061 |
||
Wartość średnia CI2 w fazie |
0.00425 |
0.061 |
|||
30oC
|
|
w. wodna [cm³] |
w. wodna [cm³] |
w. organiczna [cm³] |
w. organiczna [cm³] |
|
Vfazy [cm3] |
10 |
10 |
2 |
2 |
|
VNa2S2O3 [cm3] |
7.6 |
7.8 |
20.4 |
19.5 |
|
CI2 w fazie |
0.00385 |
0.0498 |
||
Wartość średnia CI2 w fazie |
0.00385 |
0.0498 |
|||
35oC
|
|
w. wodna [cm³] |
w. wodna [cm³] |
w. organiczna [cm³] |
w. organiczna [cm³] |
|
Vfazy [cm3] |
15 |
15 |
2 |
2 |
|
VNa2S2O3 [cm3] |
14.3 |
14.3 |
28.7 |
28.9 |
|
CI2 w fazie |
0.00476 |
0.0072 |
||
Wartość średnia CI2 w fazie |
0.00476 |
0.0072 |
|||
4. Opracowanie wyników:
Obliczenia prowadzimy z następujących zależności:
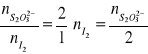
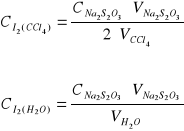
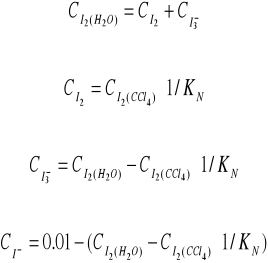
Zestawienie stężeń w różnych temperaturach:
Temperatura |
|
|
|
18 |
3.277⋅10-3 |
6.723⋅10-3 |
7.33⋅10-4 |
20 |
3.85⋅10-4 |
9.616⋅10-3 |
6.54⋅10-5 |
21 |
36.5⋅10-4 |
6.4⋅10-3 |
6.58⋅10-4 |
22 |
4.22⋅10-3 |
5.78⋅10-3 |
0.78⋅10-3 |
30 |
3.3225⋅10-3 |
6.675⋅10-3 |
5.25⋅10-4 |
35 |
4.008⋅10-4 |
9.599⋅10-5 |
7.578⋅10-5 |
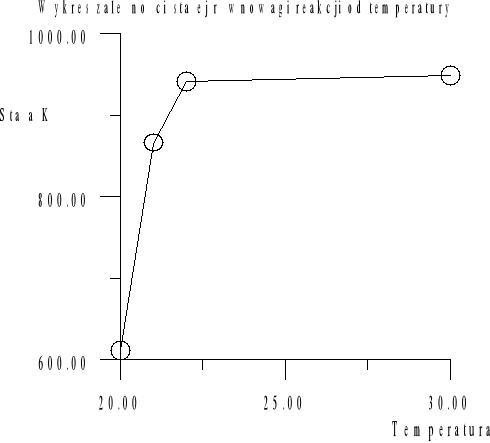
Zestawienie stałych podziału w poszczególnych temperaturach 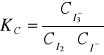
:
Temperatura [°C] |
Stała równowagi reakcji K |
18 |
665 |
20 |
611 |
21 |
866 |
22 |
942 |
30 |
949 |
35 |
551 |
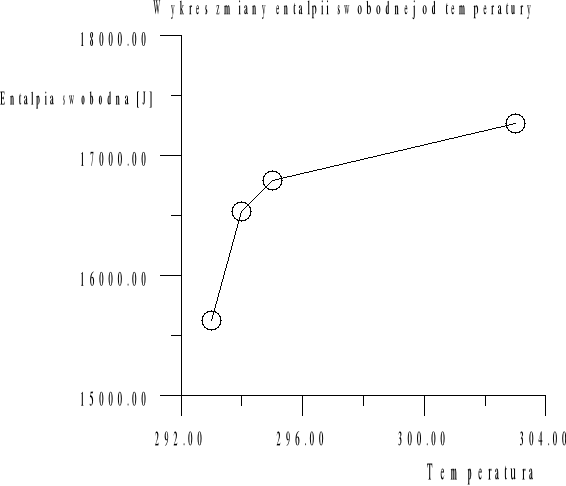
Zestawienie wartości zmian potencjału termodynamicznego ΔG w zależności od temperatury:
![]()
Temperatura [K] |
-ΔG [J] |
291 |
15725.4 |
293 |
15627.1 |
294 |
16533.0 |
295 |
16795.6 |
303 |
17269.7 |
308 |
16162.5 |
5.Wnioski:
![]()
Stała równowagi reakcji wraz ze wzrostem temperatury rośnie. Wszystkie otrzymane wartości stałej równowagi świadczą, że reakcja jest zdecydowanie przesunięta w stronę tworzenia produktów. Reakcja ![]()
jest endotermiczna co potwierdza spadek potencjału termodynamicznego wraz ze wzrostem temperatury oraz wzrost stałej równowagi. Zależność ta wyraźnie zobrazowana jest na powyższych wykresach. Zmiana potencjału termodynamicznego (ΔG<0) świadczy, że reakcja jest samorzutna. Reakcja biegnie od substratów do produktów. Przewagę produktów stwierdziliśmy miareczkując warstwę wodną i organiczną - na odbarwienie warstwy organicznej zużyliśmy więcej tiosiarczanu.
Sprawozdanie zbiorcze.
Wyszukiwarka
Podobne podstrony:
zbiorcze-krioskopia, semestr4, fizyczna, laborki, Sprawozdania
zbiorcze-krioskopia, semestr4, fizyczna, laborki, Sprawozdania
lepkość(1), semestr4, fizyczna, laborki, Sprawozdania
trójkąt Gibbsa, semestr4, fizyczna, laborki, Sprawozdania
fiele25, Mechanika i Budowa Maszyn PWR MiBM, Semestr I, Fizyka, laborki, sprawozdania z fizykii, Lab
Pomia napięcia powierzchniowego, Mechanika i Budowa Maszyn PWR MiBM, Semestr I, Fizyka, laborki, spr
fiele15, Mechanika i Budowa Maszyn PWR MiBM, Semestr I, Fizyka, laborki, sprawozdania z fizykii, Lab
Korelacja liniowa, fizyczna, chemia fizyczna, Fizyczna, CH. FIZYCZNA, laborki sprawozdania fizyczna
Fizyczna ćw 4, fizyczna, chemia fizyczna, Fizyczna, CH. FIZYCZNA, laborki sprawozdania fizyczna
Sprawozdanie 81, Mechanika i Budowa Maszyn PWR MiBM, Semestr I, Fizyka, laborki, sprawozdania z fizy
Sprawozdanie nr12, Mechanika i Budowa Maszyn PWR MiBM, Semestr I, Fizyka, laborki, sprawozdania z fi
Sprawozdanie nr43 fizyka, Mechanika i Budowa Maszyn PWR MiBM, Semestr I, Fizyka, laborki, sprawozdan
Sprawozdanie 12, Mechanika i Budowa Maszyn PWR MiBM, Semestr I, Fizyka, laborki, sprawozdania z fizy
Sprawozdanie 57c, Mechanika i Budowa Maszyn PWR MiBM, Semestr I, Fizyka, laborki, sprawozdania z fiz
pp25, Mechanika i Budowa Maszyn PWR MiBM, Semestr I, Fizyka, laborki, sprawozdania z fizykii, Labora
Dane, fizyczna, chemia fizyczna, Fizyczna, CH. FIZYCZNA, laborki sprawozdania fizyczna
więcej podobnych podstron