WOJSKOWA AKADEMIA TECHNICZNA
--------------------------------------------------------------------------------------------------------
LABORATORIUM FIZYCZNE
Grupa szkoleniowa C04J mgr inż. Leszek Kubiak
stopień i nazwisko
prowadzącego
GOLONKA Marcin
( imię i nazwisko słuchacza)
ocena końcowa ocena przygot.
do ćwiczenia
SPRAWOZDANIE
Z
PRACY LABORATORYJNEJ Nr 31
Temat: Wyznaczanie stałej Rydberga i stałej Plancka z widma liniowego wodoru.
Wstęp teoretyczny.
Dostarczając energię do atomu można doprowadzić do jego wzbudzenia. Wzbudzony atom charakteryzuje się tym, że jego elektrony znajdują się na orbitach bardziej oddalonych od jądra niż w stanie podstawowym. Po pewnym czasie elektrony wracają na swe stałe orbity powodując przy tym emisję promieniowania elektromagnetycznego. Dla każdego pierwiastka promieniowanie jest inne. Widma mogą przyjąć postać układu linii o różnych długościach fali. Jest to widmo liniowe.
Trzy postulaty Bohra:
Istnieją stacjonarne stany atomu, w których elektrony nie emitują promieniowania ( poruszają się po stałych orbitach)
Podaje sposób obliczania orbit elektronowych, odpowiadających stanom stacjonarnym. Elektron porusza się tylko po orbitach, dla których moment pędu elektronu L jest wielokrotnością ħ ( „kreślonej” stałej Plancka ).
![]()
; n = 1, 2, 3...
Dla orbit kołowych:
![]()
gdzie: me - masa elektronu,
![]()
- orbitalna prędkość elektronu
![]()
- promień orbity
Stąd:
![]()
Dotyczy energii emitowanej przy przechodzeniu przez atom ze stanu wzbudzonego ( En )do stanu mniejszej energii ( Em ). Energia fotonu jest równa:
![]()
Wiadomo, że:
![]()
Stąd:
![]()
Korzystając z postulatów Bohra możemy wyliczyć promienie orbit stacjonarnych oraz wartość energii atomu. Na elektron działają siły: odśrodkowa ( Fo ) oraz przyciągania elektromagnetycznego ( Fe ).
Fo = Fe
Stąd:
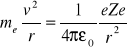
Stąd:
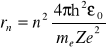
;![]()
Energia całkowita atomu ( E ) jest równa sumie energii kinetycznej elektronu ( Eke ) oraz jądra ( Ekj ) oraz energii ich wspólnego oddziaływania U.. Możemy przyjąć, że jądro jest w spoczynku. Więc:
Stąd:
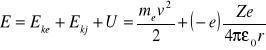
Stąd:
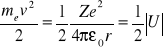
Ujemny znak energii oznacza, że elektron znajduje się w jamie elektrostatycznego potencjału jądra. Można stwierdzić, że wartości energii mogą przyjmować jedynie wartości dyskretne:
Liczbę n nazywamy główną liczbą kwantową.
Jak wynika ze wzoru, wraz ze zwiększeniem głównej liczby kwantowej n, energia atomu rośnie ( maleje jej wartość bezwzględna ). Dla n = ∞ energia atomu równa jest zero.
Skwantowane wartości energii atomu można przedstawić za pomocą poziomów energetycznych. Odległość między poziomami maleje wraz ze zwiększaniem wartości liczby kwantowej n. Stan dla n = 1 nazywamy stanem podstawowym atomu.
Żeby przejść do stanu wzbudzonego atom musi otrzymać energię z zewnątrz. Czynnik wzbudzający może posiadać energię dowolnie dużą, ale atom będzie zawsze pobierał od niego energię porcjami, odpowiadającymi różnicom między poziomami energetycznymi. Obliczymy wartość ΔE zmiany energii atomu związanej z przejściem elektronu z orbity o energii E(n) na E(k).
ΔE = E(n) - E(k)
Stąd:
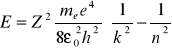
Wiemy, że:
![]()
Stąd:
![]()
gdzie: c - prędkość światła
λ - długość fali
Otrzymujemy:
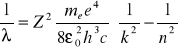
Badania wykazały, że linie w widmie tworzą grupy, zwane seriami. Dal wodoru wszystkie serie możemy zapisać jako:
![]()
gdzie: RH - stała Rydberga
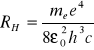
Możemy zapisać:
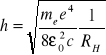
Seriom widmowym atomu wodoru nadano nazwy:
- k = 1, n = 2,3,4... - seria Lymana;
- k = 2, n = 3,4,5... - seria Balmera;
- k = 3, n = 4,5,6... - seria Paschena;
- k = 4, n = 5,6,7... - seria Brackette'a;
- k = 5, n = 6,7,8... - seria Pfunda;
Przykładowo seria Balmera zawiera cztery linie widzialne ( czerwona, niebieska, dwie fioletowe ).
Wyniki pomiarów.
nr. Linii |
1 |
2 |
3 |
[nm] |
656,2 |
466,1 |
434 |
S (od siebie) |
657,2 |
461,5 |
433 |
S (do siebie) |
657,3 |
461,5 |
433,1 |
śr. S |
657,25 |
461,5 |
433,05 |
delta S |
0,5 |
0,2 |
0,2 |
Obliczenia
Wyznaczam stałą Rydberga ze wzoru: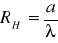
,gdzie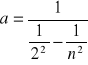
Wzór ten dla każdej linii wodoru przyjmuje postać:
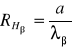
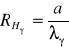
Następnie liczę wynikową wartość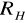
ze wzoru:
Uzyskaną wartość średnią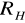
podstawiam do zależności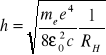
w celu wyznaczenia wartości stałej Plancka.
Z uwagi na precyzyjne wyznaczenie położenia wybranych linii spektralnych można przyjąć, że błąd względny wynosi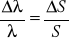
.
Następnie wyliczam graniczny błąd względny wyznaczenia stałej Rydberga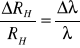
, a później błąd względny stałej Plancka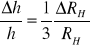
.
Do powyższych obliczeń skorzystałem z pomocy programu Excel.
|
alfa |
beta |
gamma |
|
n |
3 |
4 |
5 |
|
a |
7,2 |
5,3333333 |
4,7619048 |
RHśr [1/m] |
RH [1/m] |
10954736 |
11556519 |
10996201 |
11169152 |
me [kg] |
9,1E-31 |
|
|
lambda1 |
lambda2 |
lambda3 |
e [C] |
1,6E-19 |
|
bł.wzgl.lambda |
0,00076 |
0,00043 |
0,00046 |
epsilon [F/m] |
9,85E-12 |
|
|
|
|
|
c [m/s] |
300000000 |
|
bł.wzgl. RH |
0,00076 |
|
|
|
|
|
|
|
|
|
h |
6,12077E-34 |
|
bł.wzgl h |
0,00025 |
|
|
Wnioski
Ćwiczenie laboratoryjne miało na celu wyznaczyć stałą Rydberga i stałą Plancka. Doświadczalnie wyznaczona stała Rydberga wynosi 1,116*107 [1/m], gdzie błąd względny wynosi 0,00076. Tablicowa wartość stałej Rydberga wynosi 1,097*107 [1/m], a więc wystąpiła rozbieżność, lecz nie jest ona bardzo duża. Podobna rozbieżność wystąpiła w wyznaczeniu stałej Plancka, gdzie otrzymana wartość wyniosła 6,120*10-34 przy błędzie względnym 0,00025. Tablicowa wartość stałej Plancka wynosi 6,626*10. Może to być spowodowane niedokładnością pomiarów, bądź też, złym stanem technicznym urządzenia.
Wyszukiwarka
Podobne podstrony:
lab 13, Notatki, FIZYKA, SEMESTR II, laborki, lab
Lab 28, Notatki, FIZYKA, SEMESTR II, laborki, lab
Lab 15, Notatki, FIZYKA, SEMESTR II, laborki, lab
21 nasza, Notatki, FIZYKA, SEMESTR II, laborki, lab
Lab 9, Notatki, FIZYKA, SEMESTR II, laborki, lab
lab 21, Notatki, FIZYKA, SEMESTR II, laborki, lab
Lab fizyki, Notatki, FIZYKA, SEMESTR II, laborki, lab
Lab 12, Notatki, FIZYKA, SEMESTR II, laborki, lab
M07 - sprawozdanie-ewela, Notatki, FIZYKA, SEMESTR II, laborki, laborki fizyka II sem - ewel+jarecki
12, Notatki, FIZYKA, SEMESTR II, laborki, laborki fizyka II sem - ewel+jarecki, PIERDOŁY 12
IV WYNIKI TEORETYCZNE, Notatki, FIZYKA, SEMESTR II, laborki, laborki fizyka II sem - ewel+jarecki, P
1231231231231, Notatki, FIZYKA, SEMESTR II, laborki, laborki fizyka II sem - ewel+jarecki, pierdoły
Twierdzenie Steinera, Notatki, FIZYKA, SEMESTR II, laborki, laborki fizyka II sem - ewel+jarecki, pi
sprawozdanie 31, Budownictwo UZ semestr I , II, Chemia budowlana, Sprawozdania
Fizyka semestr II
fizyka2a, 3 semestr, Wytrzymka laborki
Fizyka semestr II
więcej podobnych podstron